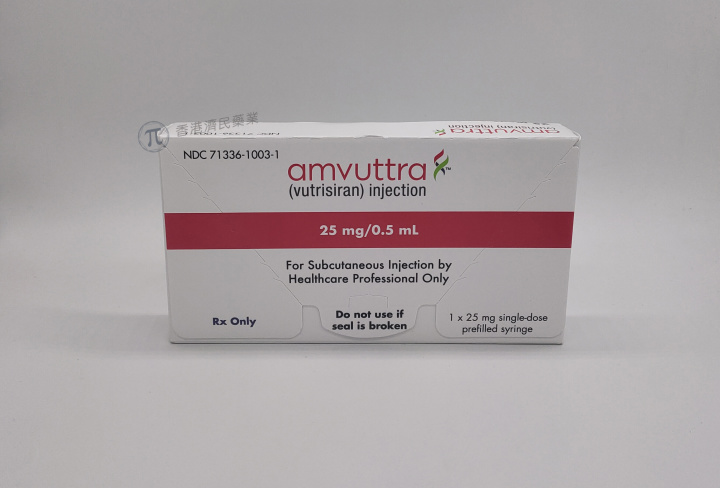
据Alnylam制药3月20日的新闻稿,美国食品药品监督管理局(FDA)已批准其RNA干扰治疗药物Amvuttra(通用名:vutrisiran)的补充新药申请(sNDA),用于治疗成人野生型或遗传性转甲状腺素蛋白淀粉样变性心肌病(ATTR-CM),以降低心血管死亡率、心血管住院率和紧急心力衰竭就诊率。该药物最初于2022年获FDA批准,用于治疗成人遗传性转甲状腺素蛋白淀粉样变性伴多发性神经病(hATTR-PN)。
此次批准使Amvuttra成为了FDA批准的第一个也是唯一一个用于治疗成人ATTR-CM和hATTR-PN的治疗药物。
转甲状腺素蛋白淀粉样变性心肌病(ATTR-CM)是一种罕见的心脏疾病,也被称为“淀粉心”。该疾病主要是由于不稳定的转甲状腺素蛋白(TTR)在异常解离后错误折叠,形成淀粉样物质并沉积在心肌间质中。这些淀粉样物质会使心肌变硬,进而引发心衰。这是一种渐进性致命疾病,目前无法治愈。
Amvuttra是一种皮下注射的RNA干扰治疗剂,每年仅需4次皮下注射,可抑制肝脏转甲状腺素蛋白的产生,阻断淀粉样纤维的形成,从源头上解决疾病问题。
ATTR-CM适应症的批准基于一项多中心、国际、随机、双盲、安慰剂对照试验(HELIOS-B,NCT04153149),评估了Amvuttra对654名患有野生型或遗传性ATTR-CM的成年患者的疗效。患者按1:1的比例随机分配接受每3个月一次皮下注射25毫克Amvuttra(n=326)或匹配的安慰剂(n=328)。根据起始是否使用氯苯唑酸(tafamidis)、ATTR疾病类型(wtATTR或hATTR淀粉样变性)以及起始纽约心脏协会(NYHA)I级或II级和年龄<75岁与其他所有因素对治疗分组进行分层。受试者被允许在研究期间开始使用开放标签的氯苯唑酸。共有85名受试者开始使用氯苯唑酸:Amvuttra组44名(22%),安慰剂组41名(21%)。这85名受试者开始使用氯苯唑酸的中位时间为18个月。
主要疗效终点是在总体人群和单药治疗人群中进行评估的长达36个月的双盲治疗期间全因死亡率和复发性心血管事件的综合结果。单药治疗人群定义为在研究起始时未接受氯苯唑酸治疗的患者。心血管事件定义为心血管住院和紧急心力衰竭[UHF]就诊。
与安慰剂相比,Amvuttra治疗使总体人群的全因死亡和复发性心血管事件风险降低28%,而接受单一疗法治疗的患者风险降低33%。大多数死亡(77%)与心血管相关。在单药治疗人群中与接受安慰剂的患者相比,接受Amvuttra治疗将全因死亡和心血管事件风险分别降低了29%和33%,而在总体人群中分别降低了31%和27%。
在总体人群和单药治疗人群中,主要复合终点的亚组分析结果与预先指定的亚组一致。
Amvuttra对功能能力和健康状况的治疗效果分别通过从起始到第30个月的6分钟步行测试(6-MWT)步行距离和堪萨斯城心肌病问卷-总体总结(KCCQ-OS)评分的变化来评估。
在总体人群和单药治疗人群中,6-MWT步行距离相对于起始的变化的LS平均差异为22米和25米,KCCQ-OS相对于起始的变化的LS平均差异为6和8,均表明amvuttra优于安慰剂。
安全性分析显示,安慰剂组与治疗组之间的不良事件发生率相似,接受Amvuttra治疗的患者中有62%出现严重不良事件,接受安慰剂治疗的患者中有67%出现严重不良事件。在该试验中未发现新的安全问题。最常见的不良反应(≥5%)是肢体疼痛、关节痛、呼吸困难和维生素A减少。
目前,基于HELIOS-B数据的上市许可申请正在接受多家全球卫生机构的审查,其中包括欧洲药品管理局(EMA)、巴西卫生监管局(ANVISA)和日本药品和医疗器械管理局(PMDA)。Alnylam制药表示,仍有望在2025年为vutrisiran提交更多全球监管申请。
除了Amvuttra,该公司还在开发第三代靶向转甲状腺素蛋白(TTR)的RNAi疗法nucresiran(曾用名ALN-TTRsc04),2024年11月公布的一期试验数据显示,单剂量给药6个月后,TTR水平持续快速下降。Alnylam预计今年上半年将启动三期研究。
参考来源:
Alnylam announces FDA approval of Amvuttra® (vutrisiran), the first RNAi therapeutic to reduce cardiovascular death, hospitalizations and urgent heart failure visits in adults with ATTR amyloidosis with cardiomyopathy (ATTR-CM). News release. Alnylam. March 20, 2025.
注:以上资讯来源于网络,由香港济民药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。