ALK-Abello A/S昨日宣布,美国食品药品监督管理局(FDA)已扩大屋尘螨过敏药片ODACTRA的适用年龄范围至5-11岁儿童。该药物适用于治疗患者因屋尘螨过敏引起的过敏性鼻炎(无论是否伴有结膜炎),此前仅被批准用于12-65岁患者。
据估计,在全球范围内,有超过一千万年龄在5至11岁的儿童患有无法控制的呼吸道过敏。屋尘螨是过敏的常见原因,并与哮喘密切相关。
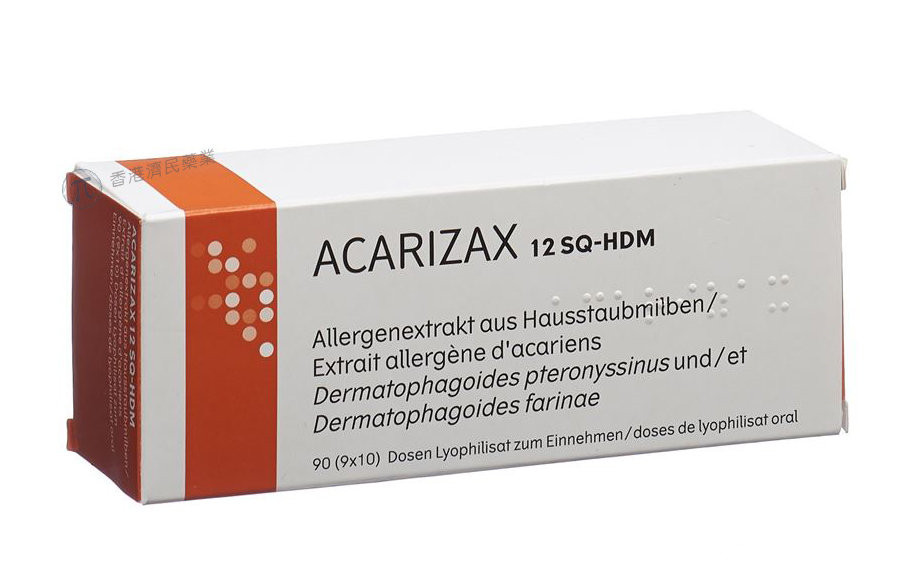
ODACTRA是一种过敏免疫治疗片剂,可在舌下溶解,帮助患者减轻过敏症状和对对症药物的依赖。该药目前已在多国上市,在欧洲名为ACARIZAX,在日本名为MITICURE,在印度名为Sensimune。到目前为止,该药片已在欧洲和日本获准供儿童使用。加拿大目前正在进行相应的监管审查。
此次批准基于一项在欧洲、美国和加拿大进行的为期约12个月的双盲、安慰剂对照、随机实地效力研究MT-12的结果。该研究比较了ODACTRA(N=693)和安慰剂(N=706)在治疗5至11岁患有或不患有哮喘的HDM过敏性鼻炎/鼻结膜炎儿童中的疗效。
主要终点是在最后大约8周的治疗期间,治疗组和安慰剂组的平均总综合鼻炎评分(TCRS)的差异。总综合鼻炎评分代表鼻炎每日症状评分(DSS)和鼻炎每日用药评分(DMS)的总和。本研究中的其他次要终点包括鼻炎每日症状评分、鼻炎每日用药评分和总综合评分(TCS)。总综合评分是鼻结膜炎每日症状评分和鼻结膜炎每日用药评分的总和,在治疗的最后8周进行评估。
两个治疗组的起始平均总综合鼻炎评分约为18(范围为0-24),并且两个治疗组的平均鼻炎每日症状评分和鼻炎每日用药评分分别约为8和10(范围为0-12)。
结果显示,在治疗的最后8周期间的总综合鼻炎评分上,与安慰剂组(4.4分)相比,ODACTRA组(3.4分)降低了22%。此外,ODACTRA组患者在症状严重程度、药物使用和生活质量也有所改善,相对于安慰剂组在每日症状评分、鼻炎每日用药评分和总综合评分降低超过22%。
接受ODACTRA治疗的儿科受试者(5至11岁)中,≥10%报告的最常见不良反应为:口腔发痒、咽喉刺激/发痒、耳朵发痒、胃痛、嘴唇肿胀、舌头疼痛、食物味道不同、恶心(想吐)、口腔后部肿胀、舌头肿胀和口腔溃疡。
参考来源:
‘FDA approves ODACTRA® for the treatment of house dust mite allergy in young children’, press release. ALK-Abello A/S; published February 27, 2025.
注:以上资讯来源于网络,由香港济民药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。