CSL Behring于当地时间2月13日宣布,欧盟委员会(EC)已批准Andembry(garadacimab,加达西单抗),用于预防12岁及以上成年和青少年患者的遗传性血管性水肿(HAE)发作。
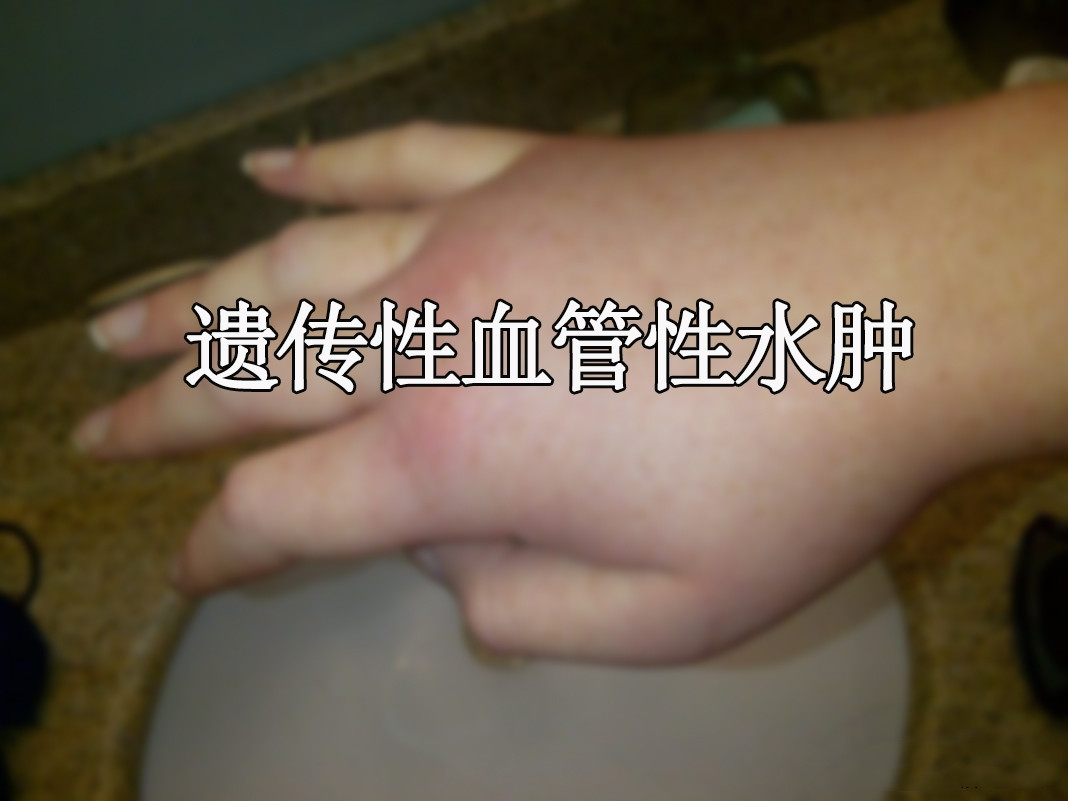
HAE是一种罕见的、遗传性的、可能危及生命的原发性补体缺陷病,以发作性、自限性、局限性皮肤和黏膜非凹陷性水肿为特征。可导致腹部、喉部、面部和四肢以及身体其他部位的疼痛、衰弱和不可预测的肿胀发作。
Garadacimab是一种抗FXIIa的单克隆抗体,特异性抑制血浆蛋白FXIIa。当FXII被激活时,会启动导致水肿形成的级联反应。通过靶向FXIIa,garadacimab能在反应最初阶段就阻断级联反应的信号传导。
新闻稿中指出,Andembry是首款只需每月一针、靶向血浆蛋白因子XIIa(FXIIa)的HAE发作预防疗法。
Andembry已于2025年1月14日获得澳大利亚治疗用品管理局(TGA)批准,于2025年1月24日获得英国药品和保健品管理局(MHRA)批准。该药物目前正在接受美国、日本、瑞士和加拿大监管机构的审查。
批准是基于关键性3期VANGUARD临床试验及其开放标签扩展研究的疗效和安全性数据。VANGUARD试验的详细结果已于2023年4月发表于《柳叶刀》,而正在进行的开放标签扩展研究的主要结果则于2024年10月发表于Allergy期刊。
3期VANGUARD临床试验评估每月一次皮下注射Garadacimab预防遗传性血管性水肿的有效性和安全性。研究参与者按3:2随机分配,在第1天接受400mg garadacimab(n = 39)皮下注射(SC)作为负荷剂量,然后每月一次接受200mg SC或安慰剂(n=25)治疗6个月。主要终点是6个月治疗期间(第1天至第182天)研究者评估的时间标准化遗传性血管性水肿发作次数(每月遗传性血管性水肿发作次数)。
结果显示,每月一次给药garadacimab的患者(n=39)与安慰剂对照组的患者(n=25)相比,其每月发作率在统计学上显著降低(p<0.001):平均发作率减少86.5%,发作率中值减少100%。调整发作率基线后,与安慰剂相比,其平均发作率减少89.2%。
总体而言,在6个月的试验中,大多数(61.5%)实验组的受试者没有发作,而安慰剂组所有病人均有病情发作;74.4%的实验组受试者在磨合期内实现了≥90%的发作减少。
该研究还显示,garadacimab表现出良好的安全性和耐受性。实验过程中没有出现导致治疗中止的不良事件。两名接受garadacimab治疗的患者(5.1%)和三名接受安慰剂治疗的患者(12%)报告了五次注射部位反应,均为轻微反应。
参考来源:
European Commission Approves CSL's ANDEMBRY® (garadacimab) for the Prevention of Recurrent Attacks of Hereditary Angioedema (HAE). Retrieved February 13, 2025.
注:以上资讯来源于网络,由香港济民药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。