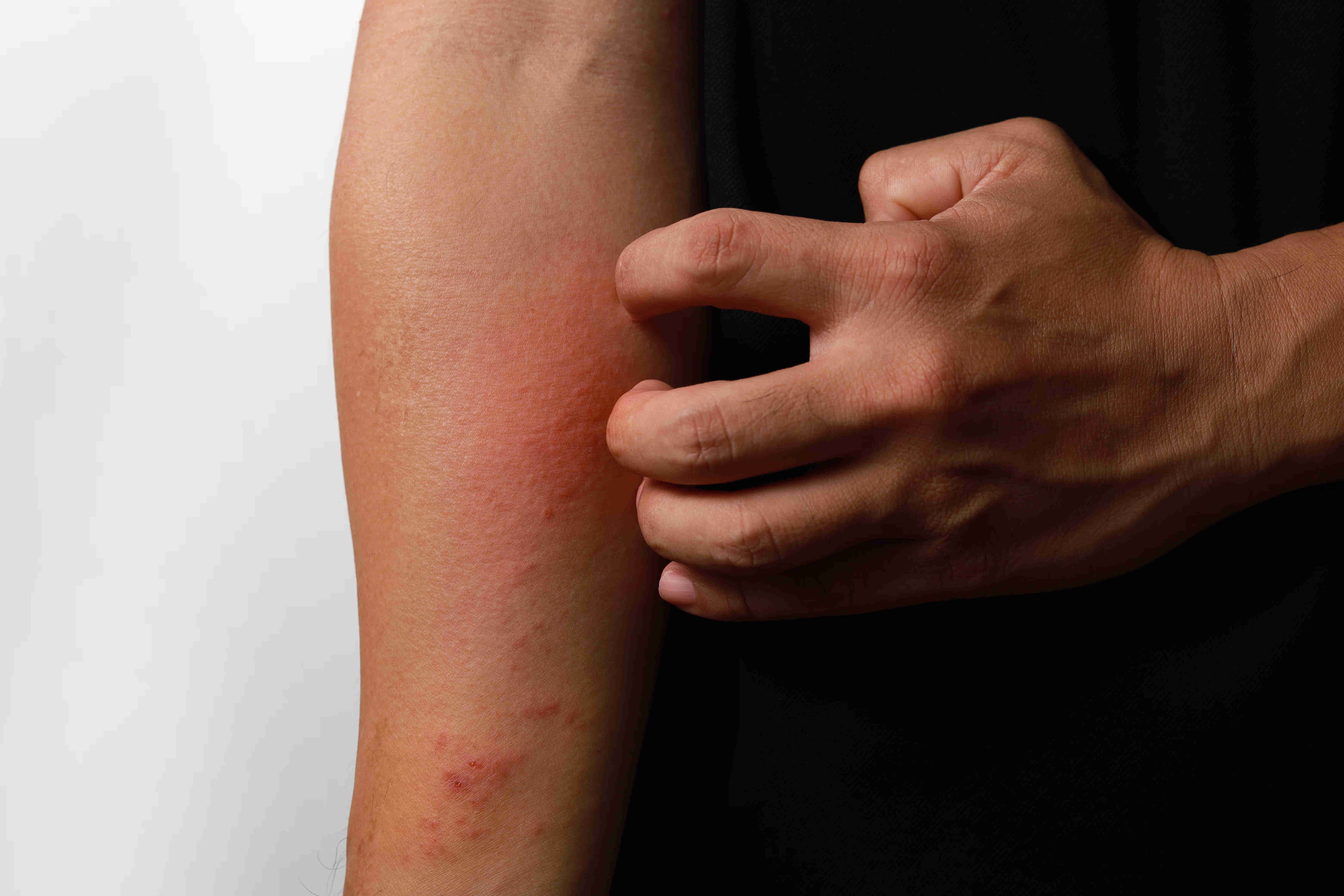
Nektar Therapeutics生物技术公司于2月10日宣布,美国食品药品监督管理局(FDA)已授予Rezpegaldesleukin快速通道资格,用于治疗患有中度至重度特应性皮炎的成人和12岁及以上的儿童患者,这些患者的病情无法通过局部处方疗法得到充分控制,或不宜采用局部处方疗法。
Rezpegaldesleukin是一种研究性生物疗法,它针对体内的白细胞介素2受体复合物,以刺激被称为调节性T细胞(Tregs)的抑制性免疫细胞的增殖。通过激活这些细胞,该药物可能会使免疫系统恢复平衡。
一项随机、安慰剂对照的1b期研究(ClinicalTrials.gov识别号:NCT04081350)的数据支持快速通道的指定,该研究评估了18至70岁确诊为特应性皮炎的患者皮下注射Rezpegaldesleukin至少12个月的安全性。
研究结果显示,两种剂量的Rezpegaldesleukin都是安全且耐受性良好的(主要终点)。与安慰剂相比,在高剂量Rezpegaldesleukin组(24μg/kg,每2周一次,共12周)中,湿疹面积和严重程度指数(EASI)评分较基线有所改善(P = .002)的患者比例显著增加,并且在第12周时体表面积有所改善(P = .0158)。在停止治疗后,通过36周的延长随访期,在高剂量组中观察到持续的反应,无需额外的特应性皮炎治疗。
新闻稿中指出,与目前需要持续给药的疗法相比,Rezpegaldesleukin有可能减少治疗负担并提高依从性。
目前,Nektar Therapeutics正在对Rezpegaldesleukin进行2b期REZOLVE-AD研究(ClinicalTrials.gov标识符:NCT06136741),研究对象为398名患有中度至重度特应性皮炎的成年患者,这些患者之前未接受过生物制剂或Janus激酶抑制剂的治疗。在为期16周的诱导治疗期内,患者随机接受三种不同剂量的rezpegaldesleukin和安慰剂治疗。在此期间之后,符合湿疹面积和严重程度指数(EASI)评分阈值以进入维持治疗的患者被重新随机分配到两种维持治疗方案中的一种,以其原始剂量水平接受每月一次或每三个月一次的维持治疗。
研究的主要终点是16周诱导治疗期结束时EASI评分的平均改善。次要终点包括获得经验证的研究者全球评估(vIGA-AD)0或1分的患者比例,获得EASI-75分的患者比例,以及瘙痒数字评分量表(NRS)获得大于或等于4分改善的患者比例。
除了REZOLVE-AD研究之外,Rezpegaldesleukin也在REZOLVE-AA研究(NCT06340360)中进行评估,这是一项随机、双盲、安慰剂对照的2b期临床试验,用于治疗重度至极重度斑秃患者。
参考来源:
Nektar Therapeutics receives Fast Track designation for rezpegaldesleukin for the treatment of moderate-to-severe atopic dermatitis. News release. Nektar. February 10, 2025.
注:以上资讯来源于网络,由香港济民药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。