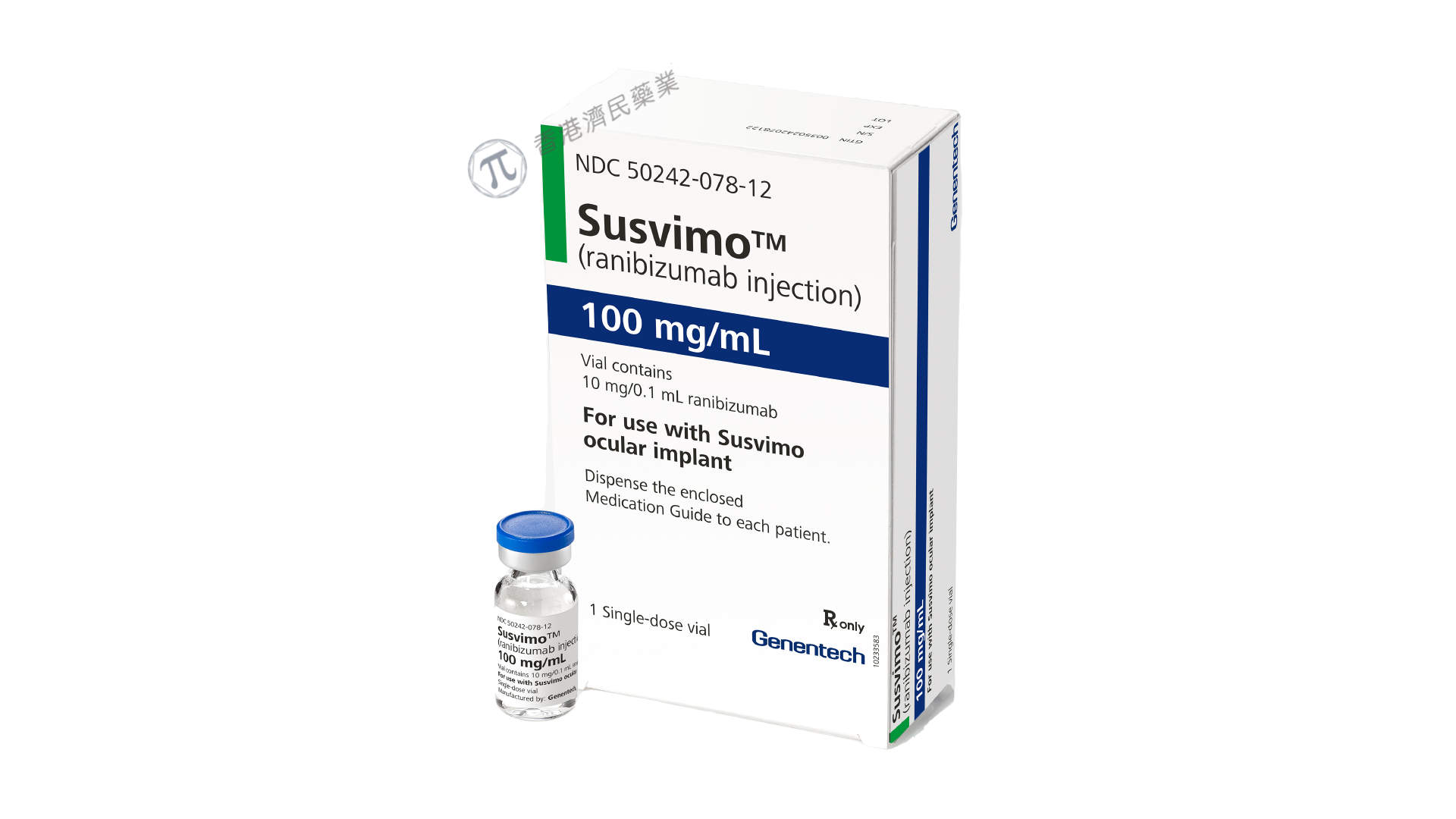
罗氏旗下基因泰克于2月4日宣布,美国食品药品监督管理局(FDA)已批准Susvimo(ranibizumab,雷珠单抗注射液)100mg/mL,用于治疗之前已对至少2次玻璃体内注射血管内皮生长因子(VEGF)抑制剂药物有反应的糖尿病性黄斑水肿(DME)患者。
Susvimo于2021年首次获批治疗先前对至少2次玻璃体内注射VEGF抑制剂药物有反应的新生血管性(湿性)年龄相关性黄斑变性患者。
Susvimo一种血管内皮生长因子(VEGF)抑制剂,旨在结合并抑制VEGF-A,VEGF-A是一种在新血管形成和血管渗漏中起关键作用的蛋白质。Susvimo适用于通过Susvimo眼部植入物进行玻璃体内注射。该植入物在一次性门诊手术中通过外科手术植入,并持续释放血管内皮生长因子抑制剂雷珠单抗,每24周(约6个月)补充一次。
新闻稿指出,Susvimo是首个也是唯一一个获得FDA批准的治疗方法,经证实可维持糖尿病性黄斑水肿患者的视力,且治疗次数少于标准眼部注射。
该批准基于3期PAGODA试验(ClinicalTrials.gov标识符:NCT04108156)的数据。研究参与者被随机分配接受Susvimo植入物持续给药,每24周一次(n=381)或每4周一次玻璃体内注射雷珠单抗0.5mg(n=253)。
研究结果表明,根据第60周和第64周平均远距离最佳矫正视力(BCVA)评分与基线的变化,Susvimo治疗不劣于玻璃体内雷珠单抗治疗(9.6个字母 vs 9.4个字母;差异,0.2[95% CI,-1.2, 1.6])。根据种族、性别、基线HbA1c评分、局部/黄斑激光治疗史、基线BCVA评分、既往玻璃体内抗VEGF治疗和糖尿病视网膜病变严重程度,不同亚组的结果一致。
“对于可能致盲的糖尿病眼病患者,Susvimo提供了一种独特、方便的常规眼部注射治疗替代方案,”Genentech首席医疗官兼全球产品开发负责人Levi Garraway医学博士说。
安全性方面,Susvimo报告的最常见不良反应是结膜出血、结膜充血、虹膜炎、眼痛、白内障、结膜疾病和玻璃体出血。
参考来源:
FDA approves Genentech’s Susvimo as the first and only continuous delivery treatment for the leading cause of diabetes-related blindness. News release. Genentech. February 4, 2025.
注:以上资讯来源于网络,由香港济民药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。