卫材株式会社和渤健于1月13日联合宣布,美国食品药品监督管理局(FDA)已经接受了LEQEMBI(lecanemab-irmb)100mg/mL皮下自动注射器用于每周维持给药的生物制品许可申请(BLA),治疗轻度认知障碍或轻度痴呆期疾病患者的阿尔茨海默病(AD)。其处方药使用者费用法案(PDUFA)的生效日期定为2025年8月31日。
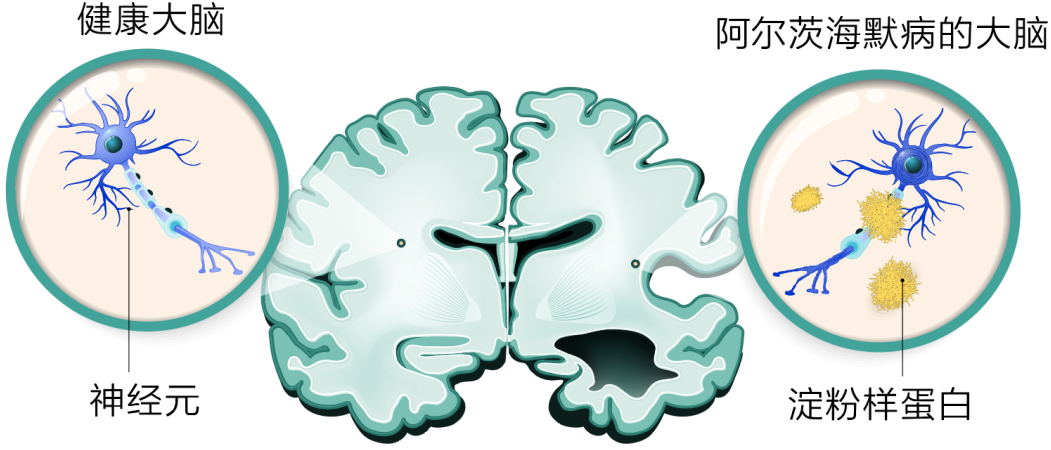
阿尔茨海默病是一种渐进性、持续性疾病,由持续的潜在神经毒性过程引起,该过程始于斑块沉积之前,并持续至斑块沉积之后。目前只有LEQEMBI具有双重作用机制,即通过持续清除原纤维和快速清除斑块来对抗阿尔茨海默病。通过持续给药,LEQEMBI可以清除高毒性原纤维,即使在清除大脑中的淀粉样β蛋白斑块后,原纤维仍会继续导致神经元损伤。
此前,该药物于2023年7月仅获批每两周给药一次,通过静脉注射。这种每两周给药一次的静脉注射剂版本已在多个国家获得上市许可,包括美国、中国、日本和英国等。在国内,该药物商品名为乐意保(通用名:仑卡奈单抗)。
皮下注射给药的BLA基于3期Clarity AD研究(ClinicalTrials.gov标识符:NCT03887455)的开放扩展数据。扩展阶段包括72名首次接受lecanemab皮下注射的参与者,以及322名之前在核心研究期间接受静脉注射lecanemab,随后在扩展研究中接受皮下制剂的参与者。
中期结果显示,与每两周一次的静脉注射相比,皮下注射lecanemab治疗6个月后脑部淀粉样斑块清除率提高了14%,通过淀粉样蛋白正电子发射断层扫描进行评估(淀粉样蛋白减少;分别为-40.3±2.27和-35.4±1.14)。此外,药代动力学数据显示,通过曲线下面积进行评估,每周一次的皮下注射制剂比每两周一次的静脉注射制剂暴露率高11%。
在安全性方面,与静脉注射相比,皮下注射全身注射反应的发生率较低。皮下制剂的淀粉样蛋白相关影像异常发生率与静脉注射制剂相当。
如果获得FDA批准,将是首个可以在家中使用皮下自动注射器进行治疗的阿尔茨海默氏病治疗方法,减少了对医院或输液点就诊进行维持治疗的需求,并提高了医护人员和患者给药的便利性和可及性。
根据披露的报告,预计皮下制剂注射过程平均需要15秒。作为皮下自动注射器360mg每周维持给药方案的一部分,已完成两周一次静脉注射初始阶段(确切时间正在与FDA讨论中)的患者将接受预计可维持临床和生物标志物益处的每周剂量。
此外,美国FDA于2024年6月接受了LEQEMBI静脉制剂用于每月一次维持给药的补充生物制剂许可申请(sBLA),并将PDUFA行动日期设定为2025年1月25日。
参考来源:
FDA accepts Leqembi® (lecanemab-irmb) Biologics License Application for subcutaneous maintenance dosing for the treatment of early Alzheimer’s disease. News release. Eisai. January 13, 2025.
注:以上资讯来源于网络,由香港济民药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。