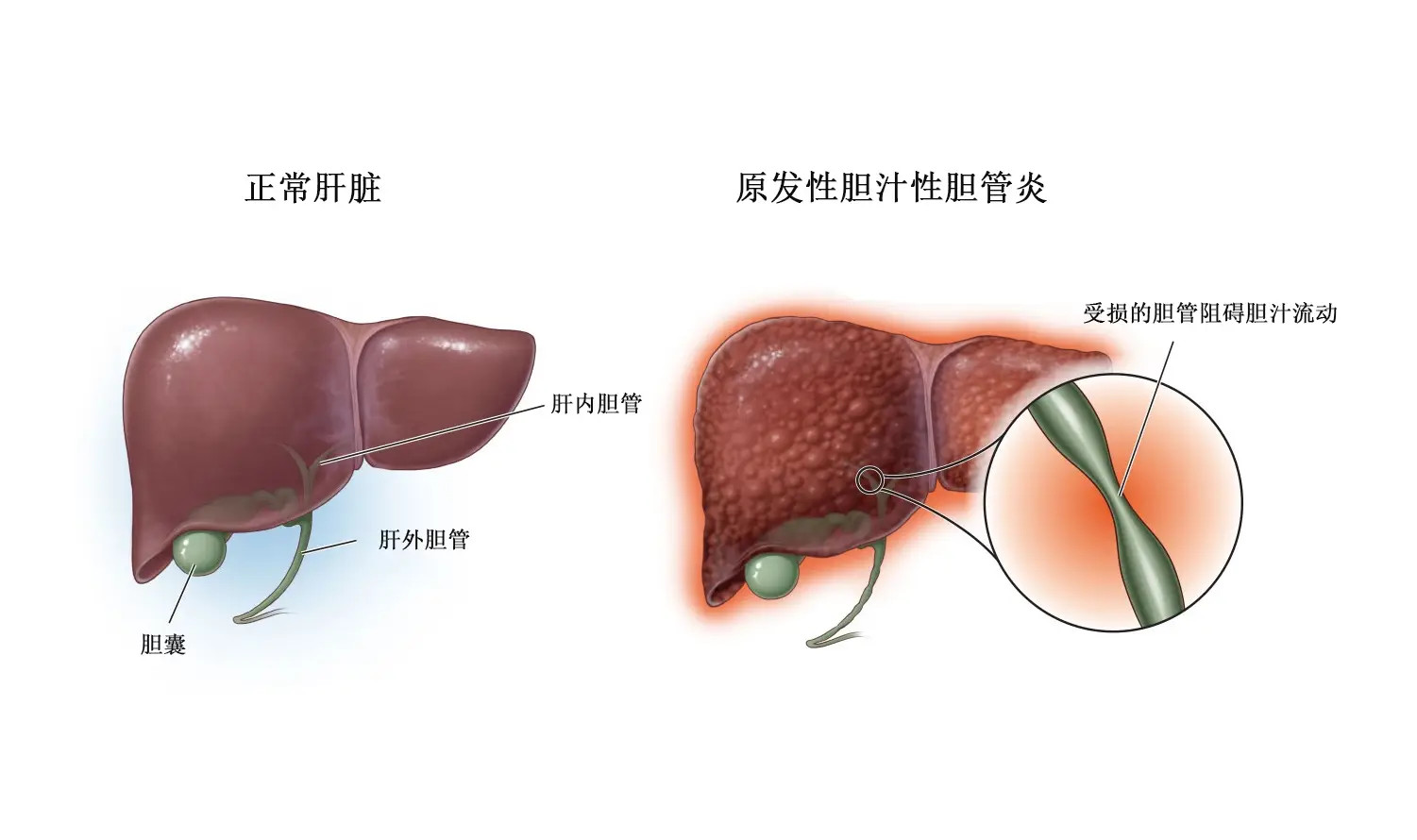
上个月中旬,吉利德科学公司公布了正在进行的3期ASSURE研究的一项为期两年半的中期分析数据,该数据显示,接受Livdelzi(seladelpar,司拉德帕)治疗的原发性胆管炎(PBC)参与者中有81%(30/37)实现了复合生化反应(CBR),表明PBC进展的一项关键指标有显著改善。此外,41%(37人中的15人)的参与者实现了碱性磷酸酶(ALP)水平的正常化,这是肝功能的一个关键生物标志物。
ASSURE(NCT03301506)是一项正在进行的开放标签研究,旨在评估Livdelzi的长期疗效和安全性。ASSURE正在招募之前参加过Livdelzi研究的PBC成年人,该研究的关键资格标准包括对熊去氧胆酸 (UDCA)反应不足或不耐受。使用2024年1月31日的数据截止时间,中期分析代表了ASSURE研究的所有参与者,包括参与过Livdelzi先前临床研究(legacy研究)的参与者和关键3期RESPONSE研究的参与者。结果表明,Livdelzi的安全性仍然强劲,在整个研究期间未报告与治疗相关的严重不良事件(SAE)。暴露调整后的不良事件发生率随着时间的推移而下降,在治疗的第1、2和3年分别观察到每100名患者年86、70和63名参与者。 Livdelzi的耐受性总体上仍然良好,在长达三年的暴露期内没有出现新的安全信号或不良事件(AE)发生频率的变化。
这一研究结果于2024年11月15日至19日在加利福尼亚州圣地亚哥举行的美国肝病研究协会(AASLD)主办的2024年肝脏会议上以最新报告的形式公布。
除了ASSURE数据外,吉利德还展示了两次口头报告的结果,重点介绍了第3阶段RESPONSE试验 (NCT04620733)的额外分析:
①一项预先指定的亚组分析强调了Livdelzi在PBC和代偿性肝硬化患者中的疗效和安全性。在第12个月,Livdelzi组肝硬化患者的ALP相对于基线的调整后平均变化为-121.4 U/L(相对于基线下降了约35%),而安慰剂组为23.2 U/L(增加了约6.6%),Livdelzi组为-134.8 U/L(下降了约43.5%),而非肝硬化患者的安慰剂组为-18.0 U/L(下降了约5.8%)。在Livdelzi参与者中,肝硬化和非肝硬化参与者中分别有89%和86%报告了不良事件,而安慰剂参与者中分别有89%和84%报告了不良事件。
②对瘙痒反应的二次分析显示,在基线时NRS评分≥4和NRS评分≥7的参与者中,Livdelzi在第12个月时分别使26.5%和18.8%的参与者的瘙痒接近消退(NRS为0或1),而安慰剂组的参与者为0%。在Livdelzi参与者中,基线NRS ≥4和NRS <4的参与者中分别有87.8%和86.1%报告了不良事件,而安慰剂参与者中分别为91.3%和81%。总体而言,无论基线瘙痒严重程度如何,Livdelzi和安慰剂的不良事件(AE)参与者比例相似。
在另一项涵盖Livdelzi治疗PBC项目的分析中,吉利德重点介绍了使用Livdelzi治疗长达五年的患者的大型安全数据库的结果,该数据库表明,考虑到各项研究的累积使用情况,Livdelzi的耐受性通常良好。共有486名参与者接受了10毫克Livdelzi,152名参与者接受了安慰剂。Livdelzi的暴露调整受试者发生率(每100名患者年)为不良事件(AE)48.3、严重不良反应(SAE)8.0和肝脏相关AE 6.1,而安慰剂参与者的AE为132(发生率反映安慰剂参与者的暴露时间较短)、SAE 7.8和肝脏相关AE 13.3。没有治疗相关的严重不良反应。
Seladelpar是一种过氧化物酶体增殖激活受体(PPAR)-delta(δ)激动剂。然而,Seladelpar在原发性胆汁性胆管炎患者中发挥治疗作用的机制尚不清楚。可能与治疗效果相关的药理活性包括通过激活PPARδ来抑制胆汁酸合成,PPARδ是一种在大多数组织(包括肝脏)中表达的核受体,调节多种代谢过程。已发表的药物研究表明,Seladelpar激活PPARδ可通过下调从胆固醇合成胆汁酸的关键酶CYP7A1来减少胆汁酸。
在今年8月15日,美国FDA已加速批准Livdelzi(seladelpar,司拉德帕)与熊去氧胆酸(UDCA)联合用于治疗对UDCA反应不足的成人原发性胆汁性胆管炎(PBC),或作为单药治疗无法耐受UDCA的患者。FDA对该药物的加速批准是基于关键安慰剂对照3期RESPONSE研究的数据,在该研究中,62%接受每日一次口服Livdelzi的患者在第12个月达到了综合生化应答的主要终点,而此数值在安慰剂组中只有20%。使用Livdelzi治疗后,25%的患者在第12个月时ALP值恢复正常,而安慰剂组中的患者均未出现这种变化。
这是首个在关键生物标志物、碱性磷酸酶(ALP,疾病进展的重要指标)正常化和瘙痒症方面与安慰剂相比实现统计学上显著改善的原发性胆汁性胆管炎治疗药物。
参考来源:
Gilead’s Livdelzi (Seladelpar) Demonstrated a Sustained Efficacy and Long-Term Safety Profile in Management of Primary Biliary Cholangitis
注:以上资讯来源于网络,由香港济民药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。