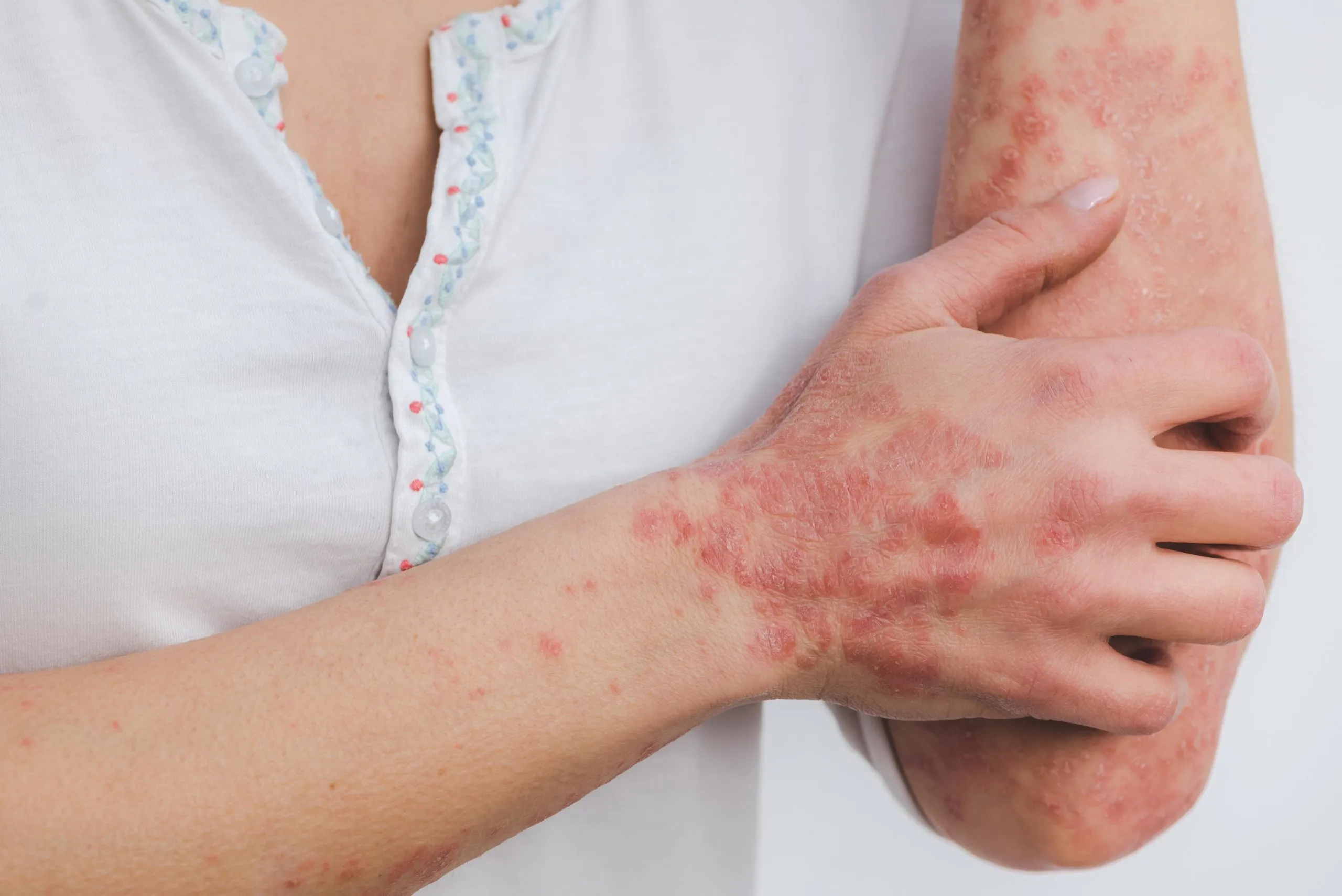
全球医疗保健公司Organon于2024年12月16日宣布,美国食品药品监督管理局(FDA)已批准VTAMA(tapinarof,本维莫德)1%乳膏,用于局部治疗成人和2岁及以上的儿科患者的特应性皮炎。
VTAMA(tapinarof)1%乳膏是一种芳烃受体激动剂,通过激活皮肤中的芳香烃受体来减少炎症并恢复皮肤屏障的正常功能。该乳膏于2022年5月获得FDA批准,用于治疗成人斑块型银屑病;使其成为25年多来美国第一个针对斑块型银屑病推出的每日一次的非类固醇外用药。
根据药物标签,VTAMA乳膏可涂抹于患处,无安全标签警告或注意事项、禁忌症,且在使用部位、使用时长和覆盖身体表面积方面没有限制。
此项批准基于两项多中心、随机、双盲、载体对照试验的数据,即ADORING 1(ClinicalTrials.gov 标识符:NCT05014568)和ADORING 2(ClinicalTrials.gov 标识符:NCT05032859)。特应性皮炎患者(N=813)按2:1的比例随机分配接受1% tapinarof乳膏或载体乳膏,每日一次涂抹在任何解剖部位的任何病变上,持续8周。
两项试验的主要疗效终点是治疗成功,定义为经过验证的研究者全球评估-特应性皮炎(vIGA-AD)评分为0(清除)或1(几乎清除),并且与基线相比至少有2级改善。
分析显示,在经过验证的研究者全球评估-特应性皮炎(vIGA-AD)中,与赋形剂相比,在第8周达到清晰(0)或几乎清晰(1)评分的患者比例以及从基线至少2级改善的患者比例具有统计学显著性差异。
在ADORING 1研究中,与接受赋形剂的患者相比,接受tapinarof乳膏治疗的患者中vIGA-AD改善的比例明显更高(45.4% VS 13.9%),而在ADORING 2研究中,Tapinarof乳膏组为46.4%,赋形剂组为18%。
此外,在接受VTAMA乳膏的患者和接受赋形剂的患者在所有次要终点方面的差异也具有统计学意义,包括在第8周湿疹面积和严重程度指数(EASI)评分比基线改善至少75%(EASI75),以及在第8周≥12岁的患者中,患者报告的瘙痒峰值数字评分量表(PP-NRS)比基线改善≥4分。
最常见的不良反应(发生率≥1%)为上呼吸道感染(12%)、毛囊炎(9%)、下呼吸道感染(5%)、头痛(4%)、哮喘(2%)、呕吐(2%)、耳部感染(2%)、四肢疼痛(2%)和腹部疼痛(1%)。
临床开发项目ADORING包含3项3期临床试验,其中ADORING 3是一项持续进行的开放标签长期扩展研究,旨在了解Vtama乳膏在长达48周的总治疗期内对AD患者的安全性和有效性。
在为期48周的开放标签ADORING长期延长(LTE)研究中,大多数患者至少进入或实现一次完全疾病清除(vIGA-AD=0),并且平均连续约80天未接受治疗(缓解效应)。
ADORING 3的安全性分析显示,VTAMA乳膏在为期8周的关键研究和48周的长期延长(LTE)研究中均表现出良好且一致的安全性;耐受性良好,包括受影响的敏感皮肤区域。长期使用未观察到任何新的安全性问题。
参考来源:
FDA Approves VTAMA® (tapinarof) cream, 1% for the Treatment of Atopic Dermatitis in Adults and Children 2 Years of Age and Older
注:以上资讯来源于网络,由香港济民药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。