近日,强生公司公布了Icotrokinra(以前称为JNJ-2113)在一项关键3期ICONIC-LEAD临床试验的积极顶线结果,该药物是首个选择性阻断IL-23受体(IL-23R)的靶向口服多肽,用于治疗12岁及以上的中度至重度斑块状银屑病(PsO)成人和青少年患者。分析显示,试验在第16周达到了银屑病面积和严重程度指数(PASI)90和研究者总体评估(IGA)0/1反应的共同主要终点,并且反应率在第24周持续改善。
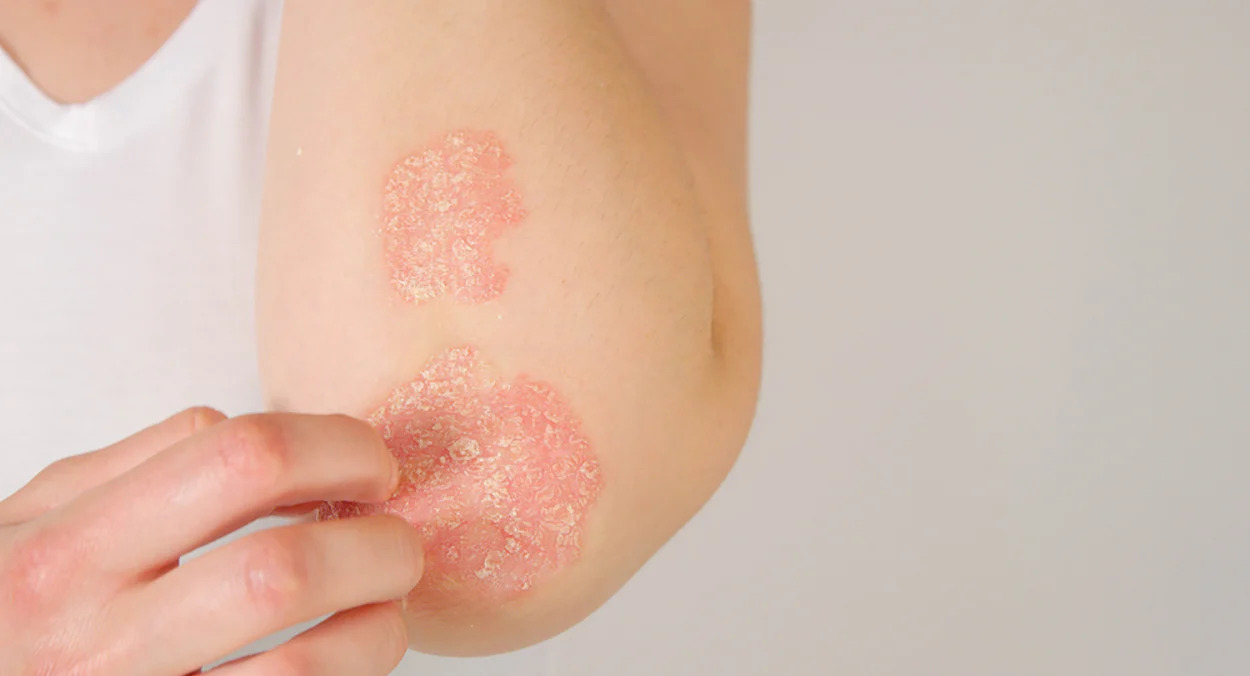
斑块状银屑病(PsO)是一种慢性免疫介导疾病,导致皮肤细胞过度生产,从而引起发炎、鳞状斑块,并可能发痒或疼痛。Icotrokinra作为首个设计用于选择性阻断IL-23受体的靶向口服多肽,可阻断白细胞介素(IL)-23受体,在中度至重度斑块性PsO和其他IL-23介导疾病的发病机制中起重要作用。
多中心、随机、双盲、安慰剂对照的ICONIC-LEAD试验(ClinicalTrials.gov识别号:NCT06095115)评估了icotrokinra对12岁及以上患有中度至重度斑块PsO的成人和青少年的安全性和有效性。研究参与者被随机分配接受口服icotrokinra或安慰剂。
共同主要终点是从基线到第16周达到研究者的全球评估(IGA)评分0/1(皮肤干净或几乎干净)且至少有2级改善的参与者的百分比,以及在第16周达到银屑病面积和严重程度指数(PASI)90反应的参与者的百分比。
结果显示:64.7%接受icotrokinra治疗的患者达到0/1的IGA评分,而接受安慰剂治疗的患者为8.3%。在第24周时,反应率继续提高,icotrokinra组的74.1%达到0/1的IGA评分。
在第16周,49.6%接受icotrokinra治疗的患者达到了PASI 90,而安慰剂组只有4.4%。在第24周,icotrokinra组的PASI 90反应率增加到64.9%。
icotrokinra的安全性与之前报告的2期研究FRONTIER 1(ClinicalTrials.gov标识符:NCT05223868)和FRONTIER 2(ClinicalTrials.gov标识符:NCT05364554)一致。第16周时,icotrokinra组和安慰剂组的治疗中出现的不良事件发生率相似(分别为49.3%和49.1%)。
ICONIC-TOTAL(ClinicalTrials.gov 标识符:NCT06095102)的积极结果也已公布,该研究评估了icotrokinra对影响特殊部位(头皮、生殖器、手掌和脚底)的斑块性银屑病患者的疗效。结果显示,与安慰剂相比,每天一次icotrokinra在第16周达到了IGA评分0/1的主要终点。
强生称,Icotrokinra还在ICONIC-ADVANCE 1(ClinicalTrials.gov标识符:NCT06143878)和ICONIC-ADVANCE 2(ClinicalTrials.gov标识符:NCT06220604)研究中与安慰剂和deucravacitinib进行了比较。ICONIC-PsA项目预计将于2025年初启动,用于评估icotrokinra对银屑病关节炎患者的疗效。
参考来源:
Icotrokinra delivered an industry-leading combination of significant skin clearance with demonstrated tolerability in a once daily pill in phase 3 topline results. News release. Johnson & Johnson. November 18, 2024.
注:以上资讯来源于网络,由香港济民药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。