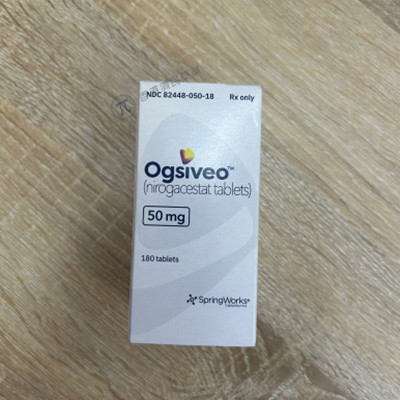
2023年11月27日,美国食品药品监督管理局(FDA)批准了制药商SpringWorks Therapeutics生产的Ogsiveo(nirogacestat), 这是首个也是目前唯一一个获得FDA批准的适用于需要口服或注射药物(全身治疗)的进展性硬纤维瘤成人患者的治疗方法。目前,该药物正在接受欧洲药品管理局(EMA)的审查。
Ogsiveo也在II期试验中进行评估,作为复发性卵巢颗粒细胞瘤患者的单一疗法,预计今年将有初步数据。
关于硬纤维瘤
硬纤维瘤也称韧带样瘤,是一种少见的良性肌腱膜过度增生。这些非癌性肿瘤通常影响15至60岁的人。肿瘤最常见于腹部、肩部、上臂和大腿,可导致疼痛、刺痛、肿胀和活动能力下降等症状,这些症状都会影响日常功能。
硬纤维瘤的治疗取决于肿瘤的大小和位置,以及疾病的进展。治疗可以包括监测肿瘤(监视)或干预,如手术、化疗、放疗或药物治疗,如酪氨酸激酶抑制剂。在没有针对性药物获批之前,该病的标准治疗是手术切除;但这种方法常常会引起高发病率和术后复发率。
Ogsiveo作用机制
Ogsiveo是一种口服、选择性、小分子γ分泌酶抑制剂,通过阻断Notch受体的蛋白水解激活来发挥作用。当Notch受体失调时,会导致肿瘤生长。γ分泌酶裂解多种蛋白质,这些蛋白质被认为在促进硬纤维瘤生长的途径中发挥作用。
Ogsiveo临床试验
FDA批准是基于双盲、安慰剂对照3期DeFi试验(NCT03785964)的数据,其结果于2023年3月发表在《新英格兰医学杂志》上。
该试验纳入了142名患有进展性硬纤维瘤且不适合手术的成年患者。患者被随机分配接受每日两次口服nirogacestat 150mg(n=70)或安慰剂(n=72)。主要终点是无进展生存期。
研究结果表明,与安慰剂相比,nirogacestat治疗可显著降低疾病进展风险71%(风险比,0.29[95%CI,0.15-0.55];P<0.001)。PFS的Kaplan-Meier中位数估计方面,Nirogacestat组未完成(not reached),而安慰剂组为15.1个月。
据报告,nirogacestat组的客观缓解率为41%,安慰剂组为8%(P<0.001);nirogacestat组的完全缓解率为7%,安慰剂组的完全缓解率为0%。nirogacestat组首次出现缓解的中位时间为5.6个月,安慰剂组为11.1个月。
Nirogacestat治疗还达到了患者报告结果的关键次要终点,包括减轻疼痛(P<0.001)和其他硬纤维瘤特异性症状(P<0.001)、改善躯体/角色功能(P<0.001)以及总体健康相关生活质量(P≤0.01)。
Ogsiveo最常见的不良反应是腹泻、卵巢毒性、皮疹、恶心、疲劳、口腔炎、头痛、腹痛、咳嗽、脱发、上呼吸道感染和呼吸困难。实验室异常包括磷酸盐减少、尿糖增加、尿蛋白增加、AST增加、ALT增加和钾减少。
在剂量和给药方面,Ogsiveo每日两次150mg,直到疾病恶化或出现不可接受的毒性。根据其标签,Ogsiveo没有黑框警告,但有严重腹泻、卵巢毒性、肝毒性、胚胎-胎儿毒性和电解质异常等警告。接受Ogsiveo治疗的患者还可能患上新的非黑色素瘤皮肤癌。
参考来源:
‘SpringWorks Therapeutics Announces FDA Approval of OGSIVEO™ (nirogacestat) as the First and Only Treatment for Adults with Desmoid Tumors’, press release. SpringWorks Therapeutics, Inc.; published November 27, 2023.
注:以上资讯来源于网络,由香港济民药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。