Biofrontera公司于近日宣布,美国食品药品监督管理局(FDA)批准了其光化性角化病治疗药物Ameluz(盐酸氨基戊酮酸)10%外用凝胶的一项补充新药申请(sNDA),将每次治疗的最大批准剂量从一管增加到三管。
此项批准使临床医生能够更灵活地为面部和头皮接受光动力疗法(PDT)治疗光化性角化病的患者处理更大或多个治疗区域,从而为临床医生及其患者带来更大的便利。
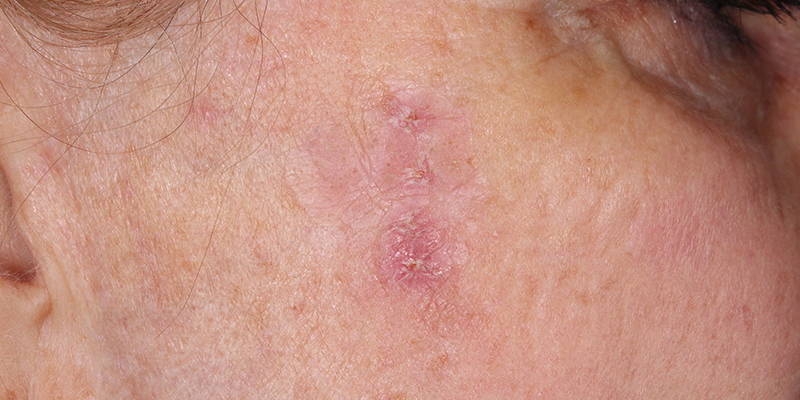
光化性角化病是与长期日晒相关的最常见的癌前皮肤病变,通常出现在面部、头皮、手臂和手背等暴露在阳光下的部位。高达60%的鳞状细胞癌始于未经治疗的光化性角化病病变。
Ameluz是一种卟啉前体,装在含有2g凝胶的管中,与使用BF-RhodoLED或RhodoLED XL灯的光动力疗法相结合,用于面部和头皮轻度至中度光化性角化病的病灶定向和区域定向治疗。
此项批准得到了两项1期安全性研究(NCT04319159;NCT05060237)数据的支持,这两项研究共纳入了116名患有光化性角化病的患者。两项研究的目的是评估局部应用三管Ameluz后,在最大使用条件下血浆中氨基戊酮酸及其代谢物原卟啉IX的药代动力学。
结果显示,氨基戊酮酸和原卟啉IX的血浆浓度低于已知会出现副作用的浓度。此外,使用三管剂量观察到的全身和使用部位的反应与先前批准的单管剂量观察到的反应相当。治疗中报告的最常见不良反应包括应用部位红斑、疼痛/灼热、刺激、水肿、瘙痒、剥落、结痂、硬结和水疱。
参考来源:
FDA approves use of up to three tubes of Biofrontera Inc.’s Ameluz (aminolevulinic acid HCI) topical gel, 10% in one treatment. News release. Biofrontera. October 7, 2024.
注:以上资讯来源于网络,由香港济民药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。