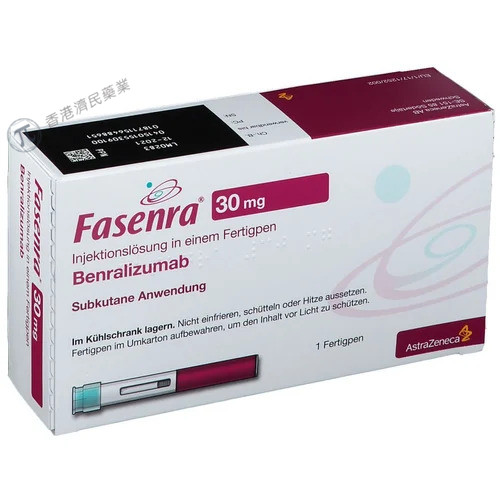
阿斯利康制药公司于9月18日宣布,美国食品药品监督管理局(FDA)批准了Fasenra(benralizumab,本瑞利珠单抗)用于治疗嗜酸性肉芽肿性多血管炎(EGPA)成年患者。根据新闻稿,Fasenra成为第二个被批准用于EGPA的生物制剂。
嗜酸性肉芽肿性多血管炎(EGPA)以前又称Churg-Strauss综合征,是一种罕见的自身免疫性疾病,会导致有过敏或哮喘病史的人出现血管炎症。该病可导致极度疲劳、体重减轻、肌肉和关节疼痛、皮疹、神经痛、鼻窦和鼻腔问题以及呼吸短促等症状。
目前的治疗方法通常是长期服用高剂量口服皮质类固醇,这可能会产生严重的副作用,并且在剂量减少时可能导致复发。
此前于2017年,美国FDA已批准用于该适应症的唯一其他药物美泊利珠单抗(商品名:Nucala),该药物由葛兰素史克公司开发。自此,Nucala成为全球首个治疗成人嗜酸性肉芽肿性多血管炎的生物制剂。
目前认为,EGPA的发病机制为嗜酸粒细胞浸润和抗中性粒细胞胞质抗体介导的血管壁损伤。这也意味着EGPA的发病,与嗜酸粒细胞升高高度相关。Fasenra是一款与嗜酸性粒细胞表面表达的IL-5Rα相结合的单克隆抗体,通过与IL-5Rα相结合,它能够募集天然杀伤细胞,通过诱发嗜酸性粒细胞的细胞凋亡过程来迅速清除这些细胞。
到现在为止,它已在包括美国、日本、欧盟和中国在内的80多个国家和地区获批作为严重嗜酸性粒细胞哮喘(SEA)的附加维持治疗。阿斯利康指出,Fasenra还在开发中,用于治疗慢性阻塞性肺疾病、慢性鼻窦炎伴鼻息肉和嗜酸性粒细胞增多综合征。
在针对140名复发或难治性EPGA患者的3期MANDARA研究中,Fasenra显示出非劣于Nucala,从而赢得了美国监管机构的支持。这项研究有一个关键的区别在剂量方面,使用Fasenra的患者每四周接受一次30mg皮下注射,而使用美泊利珠单抗的患者每四周接受三次100mg注射。
该批准得到了3期MANDARA研究(NCT04157348)的数据支持,该研究纳入了140名正在接受口服皮质类固醇(OCS;泼尼松或泼尼松龙)联合或不联合免疫抑制治疗的复发或难治性嗜酸性肉芽肿性多血管炎患者。
研究受试者被随机分配接受Fasenra 30mg皮下注射(SC),每4周一次(n=70)或美泊利珠单抗300mg皮下注射,每4周一次(n=70),同时继续接受背景治疗。主要终点是第36周和第48周缓解的患者比例(定义为伯明翰血管炎活动评分等于0且OCS剂量≤4mg/天)。
研究结果显示,Fasenra在主要终点方面不劣于美泊利珠单抗。第36周和第48周,Fasenra组的缓解率为59%,美泊利珠单抗组的缓解率为57%(差异为2.7%[95%CI,-13,18])。
两组的总累计缓解时间和首次复发时间相似。在第48至52周期间,接受Fasenra治疗的患者中41%的患者观察到OCS剂量减少100%,而接受美泊利珠单抗治疗的患者中这一比例为26%(差异为16%[95%CI,0.67-31])。
在该试验中,Fasenra的安全性和耐受性特征与其已知特征一致。
“患者通常依赖长期口服皮质类固醇,这可能会导致严重而持久的副作用,”MANDARA试验国际协调研究员Michael Wechsler博士说。“Fasenra是一种非常需要的治疗选择,数据显示,缓解不仅是嗜酸性肉芽肿性多血管炎患者可以实现的目标,而且Fasenra还可以帮助患者逐渐减少类固醇治疗。”
Fasenra以单剂量预充式注射器(10mg/0.5mL,30mg/mL)和单剂量自动注射笔(30mg/mL)提供。在EGPA,推荐剂量为每4周30mg皮下注射。
参考来源:Fasenra approved in the US for eosinophilic granulomatosis with polyangiitis. News release. AstraZeneca. September 18, 2024.
注:以上资讯来源于网络,由香港济民药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。