罗氏成员基因泰克昨日宣布,美国食品药品监督管理局(FDA)已批准皮下注射剂Ocrevus Zunovo(奥瑞珠单抗和透明质酸酶-ocsq)用于治疗成人复发型多发性硬化症(RMS),包括临床孤立综合征(CIS)、复发缓解型多发性硬化症(RRMS)和活动性继发性进展型多发性硬化症(SPMS);以及成人原发性进展型多发性硬化症(PPMS)。
Ocrevus(ocrelizumab,奥瑞珠单抗)是一种人源化单克隆抗体,旨在靶向CD20阳性B细胞,这是一种被认为造成髓鞘和神经细胞轴突损伤的特定类型免疫细胞。这种神经细胞损伤可能导致多发性硬化症(MS)患者的残疾。临床前研究显示,Ocrevus可与表达在某些B细胞表面上的CD20蛋白结合,但不与干细胞或浆细胞结合,因此患者仍可维持其免疫系统的重要功能。
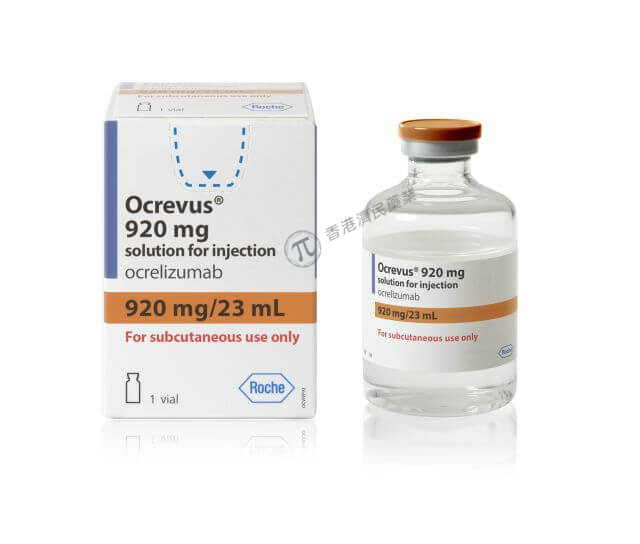
Ocrevus Zunovo是针对CD20的溶细胞抗体奥瑞珠单抗和透明质酸酶-ocsq(一种可增加皮下(SC)组织通透性的内切糖苷酶)的组合药物。该产品每年通过皮下注射给药两次,每次10分钟。
根据新闻稿,Ocrevus Zunovo是首个获批用于治疗复发型多发性硬化症(RMS)和原发性进展型多发性硬化(PPMS)的皮下制剂。
该批准基于3期OCARINA II试验(ClinicalTrials.gov标识符:NCT05232825)的数据,该试验在236名患有复发型多发性硬化症(RMS)或原发性进展型多发性硬化症(PPMS)的成人患者中比较了皮下注射(SC)Ocrevus Zunovo与静脉注射(IV)奥瑞珠单抗(Ocrevus)的疗效和安全性。
研究结果显示,皮下注射与静脉注射相比,血液中奥瑞珠单抗的水平没有临床显著差异(主要终点)。在抑制复发活动和MRI病变方面,SC制剂的治疗也与IV给药一致。Ocrevus Zunovo报告的最常见不良反应是注射部位反应。
基因泰克首席医疗官兼全球产品开发负责人Levi Garraway博士表示:“Ocrevus Zunovo为患者和提供者提供了接受Ocrevus的另一种选择,它建立在Ocrevus治疗多发性硬化症的十年稳健的安全性和有效性数据基础之上。“今天的批准可能为医疗保健提供者和多发性硬化症患者提供更大的灵活性,基于他们的个人治疗需求。”
Ocrevus Zunovo采用单剂量小瓶提供,每23毫升含920毫克奥瑞珠单抗和23000单位透明质酸酶。该产品只能由医务人员通过皮下注射到腹部。
参考来源:
FDA approves Ocrevus Zunovo™ as the first and only twice-a-year 10-minute subcutaneous injection for people with relapsing and progressive multiple sclerosis. News release. Genentech. September 13, 2024.
注:以上资讯来源于网络,由香港济民药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。