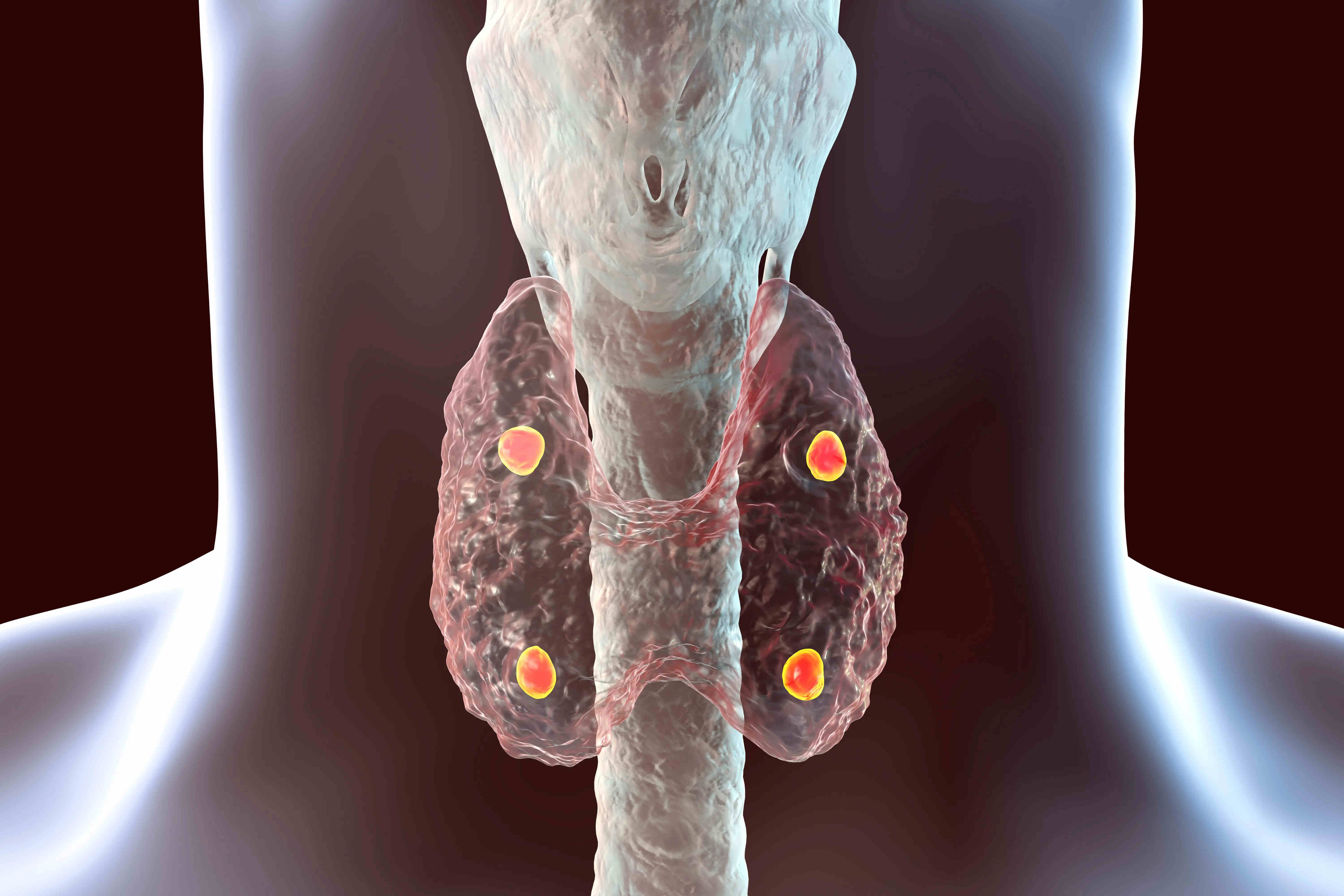
甲状旁腺功能减退症是一种内分泌系统疾病,患者甲状旁腺无法产生足够的甲状旁腺激素而导致低钙血症和高磷血症,甲状旁腺激素是调节体内钙和磷酸盐水平所必需的。颈部的四个甲状旁腺控制着钙和磷之间的关键平衡。患者最终可能会出现一系列严重且可能危及生命的短期和长期并发症,包括神经肌肉应激性、肾脏并发症、骨外钙化和认知障碍。
大多数病例(70%-80%)是手术后发生的,而其他病因包括自身免疫性和特发性的原因。钙和维生素补充剂是这种罕见疾病的常规治疗疗法,旨在缓解低钙血症,但无法恢复正常的甲状旁腺激素生理机能。
此前,对于那些无法仅通过补充剂治疗的患者,武田制药的甲状旁腺激素类似物Natpara(美国以外名为Natpar)是美国唯一的治疗方法,于2015年获得批准,作为钙和维生素D的辅助药物,用于控制甲状旁腺功能低下患者的低钙血症。该药物旨在替代甲状旁腺功能减退患者体内缺失的激素,从而帮助恢复钙水平。但由于无法解决药物药筒中微粒的制造问题,这种药物将于今年年底开始停止生产。
此外,还有一种礼来的骨质疏松症药物Forteo,其主要成分特立帕肽也是甲状旁腺激素类似物,标签外用于治疗甲状旁腺功能减退症需要每天多次注射。
Yorvipath是一种甲状旁腺激素替代疗法,采用一种与前两种药物不同的方法来提高甲状旁腺激素水平,即前体药物疗法,即在体内转化为活性药物的非活性分子。其主要成分Palopegteriparatide是甲状旁腺激素的前体药物,旨在在24小时的给药期内将甲状旁腺激素水平恢复到正常范围并保持在该范围内。该药物采用Ascendis的TransCon技术,该技术可延长药物在体内的作用时间并允许减少给药频率.
此前该药物已在欧盟和英国获得批准。根据新闻稿,Yorvipath是FDA批准的首个也是唯一一个治疗成人甲状旁腺功能减退症的药物。
据Ascendis称,Yorvipath预计将于2025年第一季度在美上市,但有可能将上市时间提前到今年第四季度,因为该公司已请求FDA批准将其已生产的剂量商业化。
该批准得到了3期PaTHway试验(ClinicalTrials.gov 标识符:NCT04701203)数据的支持,该试验包括82名患有甲状旁腺功能减退症的成年人。研究参与者被随机分配接受palopegteriparatide治疗,起始剂量为18mcg/天(n=61)或安慰剂(n=21),同时联合常规疗法(钙和活性维生素D)。
主要终点是在第26周达到以下所有指标的患者比例:白蛋白调整的钙在正常范围内(8.3-10.6mg/dL),独立于活性维生素D,独立于钙的治疗剂量(即,服用钙补充剂≤600mg/天),在第26周访视前的4周内研究药物没有增加且没有丢失活性维生素D和钙数据,以及在26周治疗期间每天一次30mcg或更少的研究药物剂量。
研究结果表明,接受palopegteriparatide治疗的患者中68.9%(42/61)达到主要终点,而安慰剂组患者中只有4.8%(1/21)达到主要终点(治疗差异为64.2% [95% CI, 49.5-78.8])。就每个单独的组成部分而言,palopegteriparatide与安慰剂的反应如下:
• 正常白蛋白校正血清钙:80.3% vs 47.6%(治疗差异,32.7% [95% CI,9.2-56.3]);
• 不依赖活性维生素D:95.1% vs 23.8%(治疗差异,71.3% [95% CI,52.5-90.2]);
• 与钙治疗剂量的独立性:86.9% vs 4.8%(治疗差异,82.2% [95% CI, 70-94.4]);
• 自第22周以来研究药物剂量没有增加:93.4% vs 57.1%(治疗差异,36.4% [95% CI,14.2-58.5]);
• 截至第26周,研究药物剂量小于或等于每天30mcg:palopegteriparatide为91.8%。
在开放标签延长期内,发现palopegteriparatide组达到主要终点的患者比例在第52周(39.3%)和第78周(39.3%)有所下降。随着剂量增加,能够维持正常血钙水平并摆脱维生素D和治疗剂量钙的患者比例在第52周为64%,在第78周为66%。
与palopegteriparatide相关的最常见不良反应是注射部位反应、血管扩张体征和症状、头痛、腹泻、背痛、高钙血症和口咽痛。
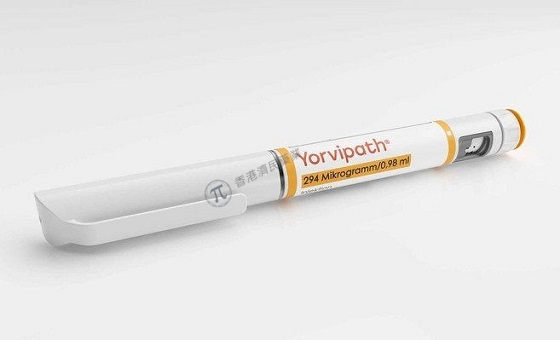
Yorvipath作为单个患者使用的预填充笔提供3种剂量强度:168mcg/0.56mL(标签剂量为6、9或12mcg);294mcg/0.98mL(标签剂量为15、18或21mcg);和420mcg/1.4mL(标签剂量为24、27或30mcg)。治疗应个体化,仅应使用1次皮下注射来达到每日一次的推荐剂量。
参考来源:
FDA Approves Yorvipath® (palopegteriparatide) as the first and only treatment for hypoparathyroidism in adults. News release. Ascendis Pharma. August 12, 2024.
注:以上资讯来源于网络,由香港济民药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。