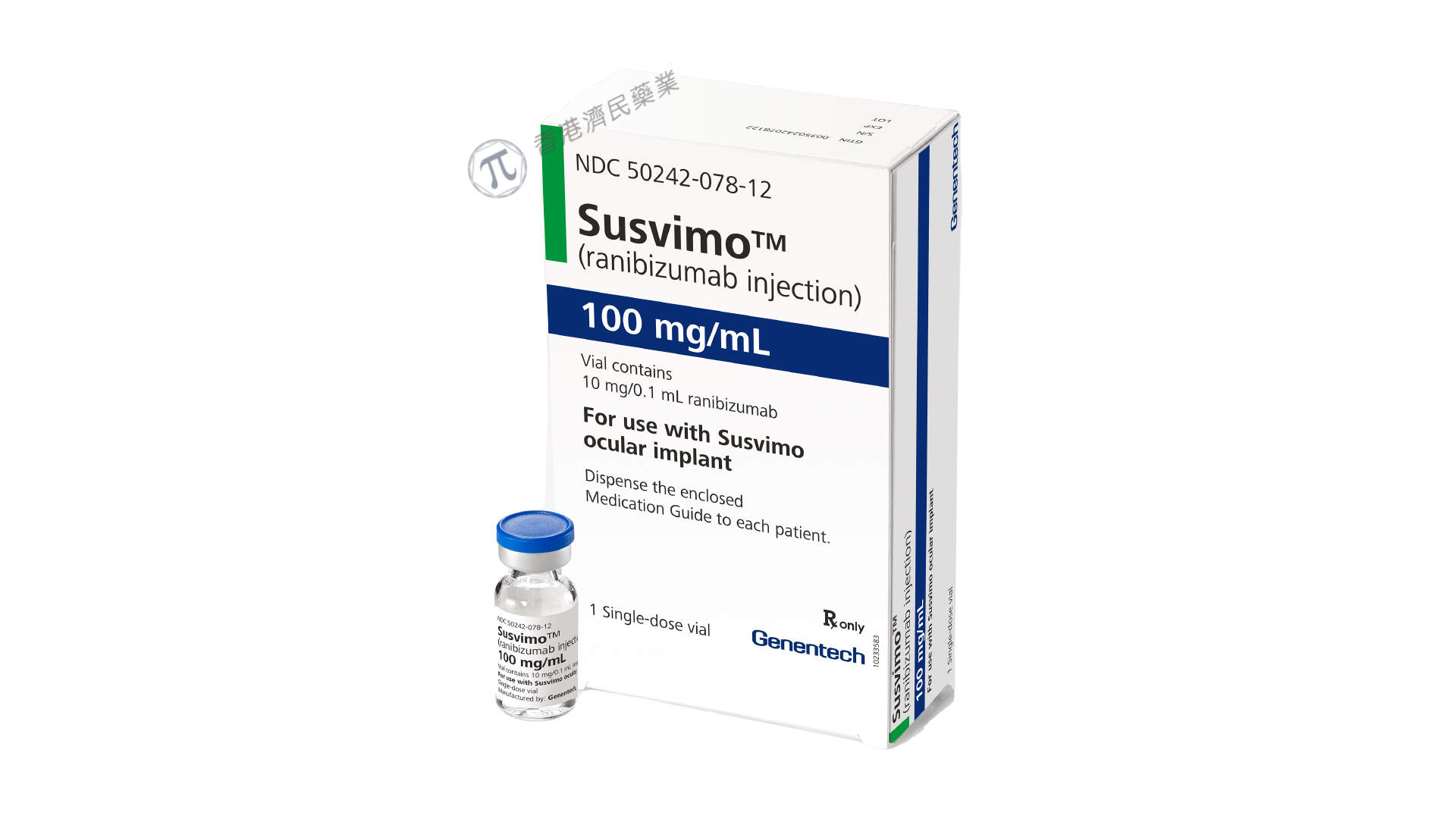
罗氏于当地时间7月18日公布了其三期Pagoda和Pavilion研究的两年数据,这些研究分别评估了Susvimo(Ranibizumab,雷珠单抗)治疗糖尿病性黄斑水肿(DME)和糖尿病性视网膜病变(DR)的疗效,该结果基于对Pagoda和Pavilion研究为期一年的初步分析,Susvimo在两年内表现出持续疗效,安全性与已知的Susvimo在DME和DR患者中的安全性一致。
详细结果在瑞典斯德哥尔摩举行的美国视网膜专科医生协会(ASRS)2024年年会上公布。
糖尿病性黄斑水肿(DME)是导致糖尿病患者视力丧失的主要原因。该病症的特征是血管渗漏到视网膜,导致肿胀和视力受损。糖尿病视网膜病变(DR)占所有视力障碍病例的约5%,它是由于血管受损和新血管形成导致血液和/或液体渗入视网膜而发生的,导致肿胀以及视网膜某些区域的血液供应受阻。
Susvimo一种血管内皮生长因子(VEGF)抑制剂,旨在结合并抑制VEGF-A,VEGF-A是一种在新血管形成和血管渗漏中起关键作用的蛋白质。
该药物也是一种可重复填充的眼部植入物;通过在一次性门诊外科手术中植入,每年只需要两次重复填充(使用专门设计的针头每6个月补充一次),帮助nAMD患者保持视力。该药物最初于2021年获得FDA批准,可在手术插入后持续输送定制配方的雷珠单抗,雷珠单抗是基因泰克公司Lucentis的活性成分。
前段时间,美国FDA基于Susvimo对眼部植入物和补充针头的组件级更新已批准其生物制品许可申请的上市后补充材料。现已在美国重新应用于治疗新生血管性或“湿性”年龄相关性黄斑变性(nAMD)。
此外,美国FDA已接受罗氏公司提交的Susvimo补充生物制品许可申请(sBLA),用于治疗糖尿病性黄斑水肿(DME)和糖尿病视网膜病变(DR)。此次申请获批是基于Pagoda和Pavilion III期研究的一年结果,结果显示:这两项研究均达到了主要终点。
关于Pagoda研究
Pagoda(NCT04108156)是一项基于美国的多中心、随机、积极治疗对照、非劣效性III期研究,旨在评估每六个月补充一次的susvimo与每月玻璃体内注射一次的ranibizumab 0.5mg相比,在634例糖尿病性黄斑水肿患者中的疗效、安全性和药代动力学。
参与者以3:2的比例随机接受每六个月一次的Susvimo再灌注或每月一次的玻璃体内注射。在Susvimo组,参与者在第16周Susvimo植入前接受了4次玻璃体内负荷剂量的ranibizumab。
该研究的主要终点是在第60周和第64周的平均水平上,最佳矫正视力得分(一个人在阅读视力表上的字母时,可以获得的最佳远距视力,包括眼镜等矫正视力)相对于基线的变化。根据初步分析,最初随机接受玻璃体内注射的参与者接受了Susvimo,每24周补充一次。
结果显示,DME患者每六个月接受一次Susvimo治疗,持续约两年(112周),并在一年后继续保持视力改善(9.8个视力表字母)。视力表字母增加9.8个相当于视力表上增加了两行。大约95%的患者不需要通过补充注射进行额外治疗。从解剖学上讲,Susvimo在第112周时显示出中央亚区厚度(CST)的持续改善。CST是衡量视网膜干燥的指标,其减少是由于不稳定、渗漏的血管导致眼球后部液体肿胀的指标。
安全性数据与DME患者已知的安全性一致,没有观察到新的安全性信号。在接受Susvimo治疗的人群中,长达一年的时间里没有报告任何眼内炎病例,第112周的眼内炎发生率为0.7%,而对照组为0.8%。成功治愈眼内炎后,受影响的参与者恢复了Susvimo的补充。
关于Pavilion研究
Pavilion(NCT04503551)是一项多中心、随机、基于美国的III期研究,旨在评估每9个月补充100mg/mL的Susvimo与接受每月临床观察的人相比,在174名患有糖尿病性视网膜病变但无中枢性糖尿病性黄斑水肿的患者中的疗效、安全性和药代动力学。
参与者按5:3随机分组,分别接受每9个月一次的Susvimo补充治疗或每月一次的临床观察。在Susvimo组,参与者在第4周Susvimo植入前接受了两次玻璃体内负荷剂量的ranibizumab。
主要终点是在第52周时,早期治疗糖尿病视网膜病变研究-糖尿病视网膜病变严重程度量表中与基线相比至少有两步改善的参与者比例。根据初步分析,在第64周Susvimo植入前,临床观察组的参与者最初接受了两次ranibizumab负荷剂量。
结果显示,接受Susvimo补充治疗的DR患者在大约两年(100周)的时间内保持了一年时的糖尿病视网膜病变严重程度评分(DRSS)改善。具体来说,在第100周,80%的Susvimo参与者的DRSS从植入前基线获得了两步或更大的改善,从第64周开始接受Susvimo的参与者保持或改善了他们的DRSS评分。DRSS的两步或更大改善是降低糖尿病继发威胁视力并发症风险的临床相关指标。约98%接受Susvimo治疗的参与者不需要额外的补充注射治疗。
安全性数据与已知的Susvimo在DR患者中的安全性一致,没有观察到新的安全性信号。在接受Susvimo治疗的人群中,一年内没有眼内炎病例报告,第100周的眼内炎发生率为0.8%。一名DR参与者出现眼内炎,并在成功解决后继续接受Susvimo填充物治疗。
参考来源:New data for Roche’s Susvimo demonstrates sustained efficacy in two serious diabetic eye conditions
注:以上资讯来源于网络,由香港济民药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。