根据6月17日Pyros制药公司的一份新闻稿,美国FDA已批准Vigafyde,这是首款也是唯一一款即用型Vigabatrin(氨己烯酸)口服溶液;适用于1个月至2岁的婴儿痉挛症患儿,其潜在益处超过了视力丧失的潜在风险。此次批准标志着15年来在该领域首次批准一种新药配方。
婴儿痉挛是一种罕见的严重癫痫,通常始于不到一岁的儿童。婴儿痉挛可能表现为细微但重复的动作,经常被忽视或误诊。这可能会导致长期的永久性问题,如持续癫痫发作、其他形式的癫痫、自闭症谱系障碍和发育问题。
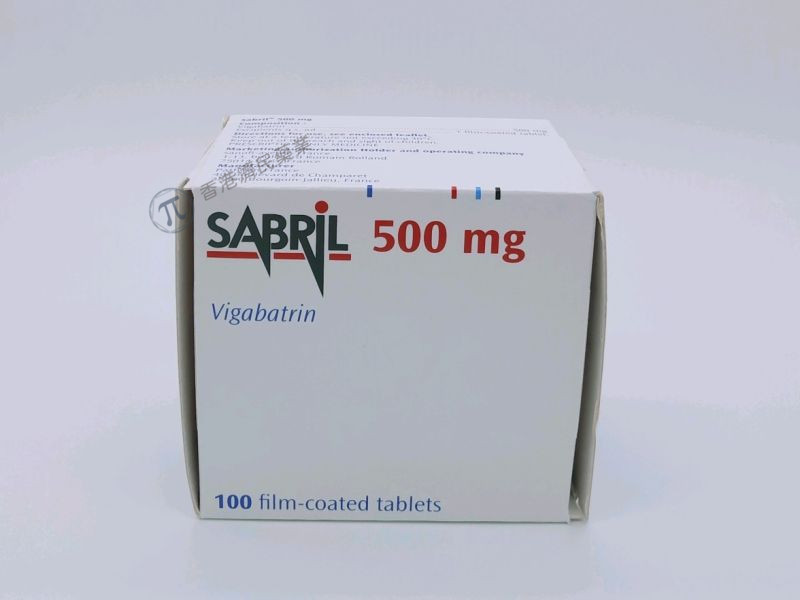
针对这种罕见的婴儿疾病,目前在美国使用灵北制药公司的喜保宁Sabril (vigabatrin,氨己烯酸)及其仿制药进行治疗,前者于2009年获得FDA批准。其通用的仿制药版本于2019年获得FDA批准上市。灵北从赛诺菲那里获得了该药物在美国的商业化权利。根据其药品标签,Sabril有500毫克片剂和500毫克口服溶液粉剂。
Vigafyde通过抑制GABA转氨酶起作用。这增加了大脑中的GABA水平,有助于调节神经元的兴奋性,从而更好地控制癫痫发作。
与其他氨己烯酸产品相比,Vigafyde是一种含有100mg/mL氨己烯酸的浓缩溶液,并且需要比其他氨己烯酸产品更小的体积来获得相同的剂量(例如,目前可获得的用于口服溶液产品的氨己烯酸的最终浓度为50mg/mL)。在开处方、配药和给药之前,验证氨己烯酸产品的浓度和剂量非常重要。
与其他氨己烯酸产品类似,Vigafyde的处方信息包括与永久性视力丧失风险相关的黑框警告。由于这种风险,该药物只能通过一个名为“vigabatrin风险评估和缓解策略(REMS)计划”的限制分销计划获得。
Vigafyde是一种150毫升瓶装的薄荷味口服溶液。Pyros计划在2024年下半年商业推出该产品。
此外,Pyros公司还在研发另外两种药物,分别是PYR-001和PYR-002,治疗目标尚未披露。PYR-001处于后期临床试验阶段,而PYR-002仍处于早期开发阶段。
参考来源:
Pyros Pharmaceuticals announces FDA approval of Vigafyde™ (vigabatrin) as the first and only ready-to-use vigabatrin oral solution. News release. Pyros Pharmaceuticals. June 17, 2024. Accessed June 18, 2024.
注:以上资讯来源于网络,由香港济民药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。