
+86 19896541773 (内地长途,搜索号码加药师微信)
投诉与建议:info@pidrug.com

在能够充分应对紧急情况的医疗设施中,仅在对癌症化疗有充分知识经验的医生的指导下,认为适合使用本剂的病例才使用本剂。治疗开始前,应向患者或其家属充分说明有效性和危险性,征得同意后再给药。
2.禁忌
请勿给下列患者使用:对本剂成分有过敏症病史的患者。
4.功效或效果
癌症化疗后恶化的胃肠道间质瘤。
5.功效或效果相关注意事项
5.1对象为伊马替尼、舒尼替尼及瑞戈非尼治疗后患者。
5.2本品作为手术辅助治疗的有效性及安全性尚未确立。
6.用法及用量
Pimitespib的常用成人剂量为160毫克,每天空腹服用一次。连续口服该药五天,然后停药两天,重复此循环。根据患者情况可适当减少剂量。
7.用法及用量相关注意事项
7.1与其他抗恶性肿瘤药物联合使用,有效性及安全性尚未建立。
7.2餐后给予本剂时,Cmax及AUC升高。为了避免饮食的影响,避免在饭前一小时到饭后两小时之间服用。[参阅16.2.1]
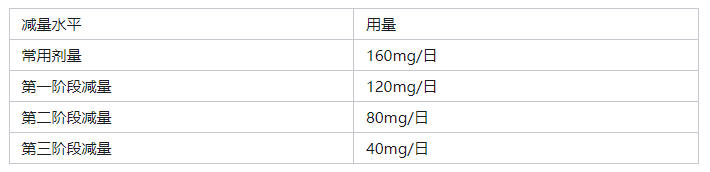
7.3出现不良反应,应根据症状、严重程度考虑以下标准,停药减量:
减少剂量

8.1可能出现严重腹泻。应密切监测患者,包括定期检查症状。[参见11.1.1]
8.2由于可能会发生眼部异常,因此应在开始服用本药前、服用期间定期检查眼部有无异常,并根据需要进行检查,密切监测患者的状态。[参见11.1.2]
9.特殊背景患者的注意事项
9.3肝功能不全患者
该药物主要在肝脏中代谢,因此血药浓度可能会升高。但尚未对中度肝功能障碍(总胆红素大于正常上限的1.5倍)患者进行临床试验。
9.4具有生殖能力的患者
9.4.1如需给予可生育患者,应考虑可能出现生殖功能减退。在动物研究(大鼠)中,已报告出现阴道上皮细胞凋亡小体增加、卵巢多发性囊肿、白癜风、黄体减少和间质腺体增生。动物研究(大鼠和狗)报告了曲细精管的退化和附属性腺的萎缩性变化,以及附睾生殖上皮的退化/坏死,并伴有精子生成减少¹⁾。
9.4.2应告知育龄女性在服用该药期间及最后一次服药后7个月内避孕的必要性和适当的避孕方法。[参见9.5和15.2]
9.4.3应告知男性在使用该药物治疗期间以及最后一次服药后4个月内需要使用屏障法(避孕套)避孕。[参见15.2]
9.5孕妇
只有当治疗益处大于风险时,才应给孕妇或可能怀孕的妇女服用该药。在对大鼠进行的胚胎-胎儿发育研究中,在低于临床暴露水平(AUC)的暴露水平下,在胚胎和胎儿中观察到生长抑制、致畸性和胎儿致死性²⁾。[参见9.4.2]
9.6哺乳期妇女
建议不要母乳喂养。此药可能会进入母乳。如果婴儿通过母乳摄入此药,可能会出现严重的副作用。
9.7儿童等
尚未对儿童或其他受试者进行临床试验。
10.相互作用
10.1相互作用序言
本剂显示CYP3A、MATE1及MATE2-K的抑制作用。
10.2合用注意事项

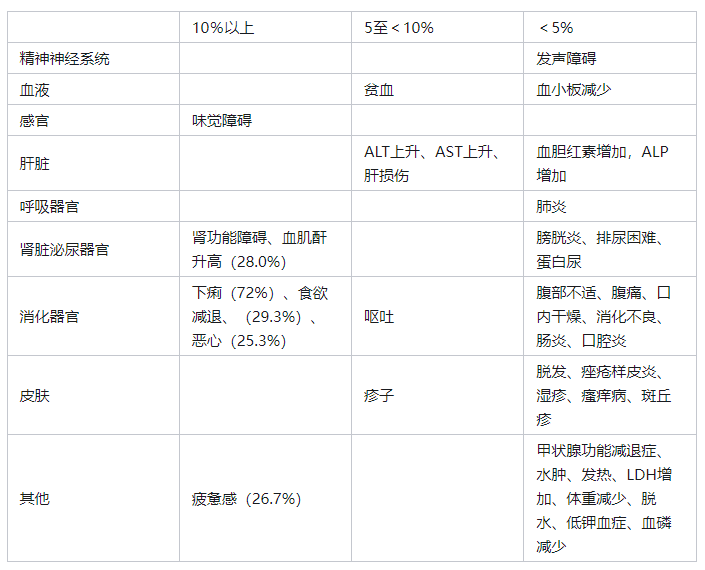
11.1严重副作用
可能会发生以下不良反应,因此请密切观察,如发现异常,请停止使用或采取适当措施。
11.1.1严重腹泻
严重腹泻(16.0%)可能导致脱水和严重的肾脏损害。[参见8.1]
11.1.2眼部疾病
可能出现以下症状:夜盲症(12.0%)、视力模糊(5.3%)、视力障碍(5.3%)、视网膜静脉阻塞(1.3%)、视网膜病变(1.3%)、后天性色觉缺陷(1.3%)。[参见8.2]
11.1.3出血
可能出现腹腔内出血(1.3%)和十二指肠溃疡出血(1.3%)。
11.2其他副作用
可能会发生以下次级不良反应,因此请密切观察,如发现异常,请停止使用或采取适当措施。
14.1配药注意事项
指导患者在服药前从PTP包装中取出药物。若不慎吞下PTP片,其坚硬、锋利的边缘可能刺穿食管黏膜,造成穿孔,引发纵隔炎等严重并发症。
15.其他说明
15.2基于非临床试验的信息
根据遗传毒性试验结果,发现了染色体结构异常诱发作用³⁾。[参见9.4.2和9.4.3]
16.药代动力学
16.1血液浓度
16.1.1重复给药
对22名日本晚期实体癌患者在空腹状态下每日口服160mg pimitespib一次时,其血浆浓度曲线和药代动力学参数如下⁴⁾。
每日一次口服160mg该药物时的血浆浓度趋势(平均值+标准差,n=22)
每日一次口服160mg该药物时的药代动力学参数

平均值±标准偏差,只有Tmax为中值(最小值~最大值),NC:不计算,a)n=18
空腹条件下每日一次口服该药160mg时,给药第5天pimitespib的蓄积率为1.27。
16.2吸收
16.2.1饮食的影响
当16名日本晚期实体癌患者单次口服160mg该药物时,高脂餐后服用pimitespib与空腹服用pimitespib的Cmax和AUCinf的几何平均比分别为1.92和1.64⁵⁾。[参见7.2]
16.3分布
pimitespib的人血浆蛋白结合率为93.1%~93.6%,主要与人血清白蛋白结合(体外)。pimitespib的人体血液/血浆浓度比为0.525-0.6306)⁶⁾(体外)。
16.4新陈代谢
Pimitespib主要由CES1代谢(体外)。对3名晚期实体癌患者以150.5mg/m²(注)反复口服该药时,给药后24小时内在尿液中均检测到了原型药物、酰胺水解物、N-去甲基化药物等⁷⁾。
16.5排泄
6名日本晚期实体癌患者口服107.5mg/m²(注)剂量的该药物时,至给药24小时后,2.2%的给药剂量以原形随尿液排出⁸⁾。
16.7药物相互作用
16.7.1咪达唑仑及二甲双胍
基于生理学药代动力学模型的模拟试验表明,与单独给予咪达唑仑(CYP3A基质)和二甲双胍(MATE1和MATE2-K基质)相比,合并使用本制剂时咪达唑仑和二甲双胍的暴露量有可能上升⁹⁾。[参见10.2]
16.7.2其他
(1)Pimitespib是P-gp和BCRP的底物(体外)。
(2)Pimitespib抑制P-gp、BCRP和OATP1B1¹⁰⁾(体外)。
注:该药品批准剂量及用法如下:Pimitespib的常用成人剂量为160毫克,每天空腹服用一次。连续口服该药五天,然后停药两天,重复此循环。根据患者情况可适当减少剂量。
17.临床表现
略¹¹⁾。[参阅完整说明书]
18.药理学
18.1作用机制
Pimitespib通过抑制HSP90的客户蛋白的高级结构的形成,从而降低参与肿瘤生长的蛋白质的表达并诱导细胞凋亡,发挥其肿瘤生长抑制作用¹²⁾¹³⁾¹⁴⁾。
18.2抗肿瘤作用
18.2.1Pimitespib对人胃肠道间质瘤衍生的GIST-T1细胞系表现出抗增殖作用¹³⁾(体外)。
18.2.2Pimitespib在皮下植入GIST-T1细胞系的裸鼠中显示出肿瘤生长抑制作用¹³⁾(体内)。
19.有关活性成分的物理化学知识
19.1.ピミテスピブ(Pimitespib)
通用名称:ピミテスピブ
英文通用名称:Pimitespib
化学名:3-乙基-4-{4-[4-(1-甲基-1H-吡唑-4-基)-1H-咪唑-1-基]-3-(丙-2-基)-1H-吡唑并[3,4-b]吡啶-1-基}苯甲酰胺
分子式:C25H26N8O
分子量:454.53
理化性质:白色结晶粉末。它在N-甲基-2-吡咯烷酮中易溶,在甲醇或乙醇(99.5)中微溶,在水中几乎不溶。
21.1制定并适当实施药品风险管理计划。
21.2由于日本临床试验病例数极其有限,因此将对所有病例进行上市后监测研究,直到积累一定病例数的数据。有必要了解使用该药品的患者的背景信息,早期收集该药品的安全性和有效性数据,并采取必要措施确保该药品的适当使用。
PTP包装:40片(10片×4)。
1.重复给药毒性试验(包括毒素评估)(2022年6月20日批准,CTD2.6.6.3)
2.胚胎-胎儿发育试验(2022年6月20日批准,CTD2.6.6.6.1)
3.遗传毒性试验(2022年6月20日批准,CTD2.6.6.4)
4.临床药理试验(2022年6月20日批准,CTD2.7.2.2)
5.临床药理试验(2022年6月20日批准,CTD2.7.1.2)
6.药代动力学试验(2022年6月20日批准,CTD2.6.4.4)
7.药代动力学试验(2022年6月20日批准,CTD2.6.4.5)
8.临床药理试验(2022年6月20日批准,CTD2.7.2.2)
9.临床药理试验(2022年6月20日批准,CTD2.7.2.3.6)
10.药代动力学试验(2022年6月20日批准,CTD2.6.4.7)
11.KurokawaY,etal.,AnnOncol.,33(9),959-967,(2022)»PubMed
12.YoshimuraC,etal.,JMedChem.,64(5),2669-2677,(2021)»PubMed
13.药效学试验(2022年6月20日批准,CTD2.6.2.2)
14.SaitoY,etal.,BrJCancer.,122(5),658-667,(2020)»PubMed
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。
