2024年12月18日,美国食品药品监督管理局(FDA)批准了Mesoblast公司生产的Ryoncil(remestemcel-L-rknd),这是一种同种异体骨髓间充质基质细胞(MSC) 疗法,用于治疗2个月及以上儿科患者的类固醇难治性急性移植物抗宿主病(SR-aGvHD)。值得一提的是,Ryoncil是首个获得FDA批准的MSC疗法。
【生产企业】:Mesoblast
【规格】:目标浓度:6.68 X 106 MSCs / mL*3.8mL,即25 x 106 MSCs/3.8mL/瓶
【商标】:Ryoncil
【通用名】:remestemcel-L-rknd
【性状】:本品为静脉输注的细胞悬液,以无菌、低温保存的体外培养扩增的同种异体骨髓间充质干细胞(MSC)细胞悬液的形式提供,装在以下包装尺寸的小瓶中:
【贮藏】:必须在液氮蒸气相中保持≤-135°C 的冷冻状态,直至给药前立即解冻。
【Ryoncil适应症和用途】
适用于治疗2个月及以上儿科患者的类固醇难治性急性移植物抗宿主病 (SR-aGvHD)
【Ryoncil用法用量】
• 静脉输注给药,具体给药方法请参阅文末【Ryoncil用药手册】
• 推荐剂量:每次按照体重2×106 MSC/kg进行静脉输注,每周两次,连续4周。输注间隔至少3天。
首次用药后第28±2天评估患者的疗效反应,并按下表1所述进行进一步治疗。
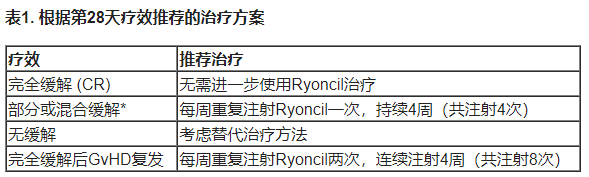 *根据国际血液和骨髓移植注册严重指数标准分级系统,部分缓解定义为至少一个阶段的器官改善,而任何其他器官没有恶化;混合缓解定义为至少一个可评估器官改善,另一个器官恶化。
*根据国际血液和骨髓移植注册严重指数标准分级系统,部分缓解定义为至少一个阶段的器官改善,而任何其他器官没有恶化;混合缓解定义为至少一个可评估器官改善,另一个器官恶化。
【Ryoncil禁忌症】
本品禁用于以下人员:已知对二甲基亚砜(DMSO)或猪蛋白和牛蛋白过敏者。
【Ryoncil不良反应】
最常见的非实验室不良反应(发生率≥20%)有:病毒感染性疾病、细菌感染性疾病、病原体不明的感染性疾病、发热、出血、水肿、腹痛和高血压等。
【Ryoncil警告和注意事项】
过敏反应和急性输液反应:给药过程中可能出现包括急性输液反应在内的过敏反应。该反应可能发生在输注期间或之后,体征和症状可能包括发烧、呼吸困难和低血压。预先给患者使用抗组胺药和皮质类固醇,并密切监测过敏或急性输注反应的体征和症状。如果发生过敏或急性输注反应,应中断Ryoncil输注;请勿对出现严重或危及生命反应的患者使用Ryoncil。
传染性病原体的传播:由于Ryoncil含有来自人类捐献者的细胞,且采用人类、猪和牛衍生试剂制造,因此在使用时可能会传播传染病或病原体。对捐献者进行人体免疫缺陷病毒1型筛查和检测(HIV-1);人类免疫缺陷病毒2型(HIV-2);乙型肝炎病毒(HBV);丙型肝炎病毒(HCV);人类T细胞白血病-淋巴瘤病毒1型(HTLV-1);人类T细胞白血病-淋巴瘤病毒2型(HTLV-2);西尼罗河病毒(WNV);巨细胞病毒;爱泼斯坦-巴尔病毒;梅毒。仅对克雅氏病(CJD)和异种移植相关的传染病风险进行了筛查和测试。 Ryoncil细胞库经过人类和动物病毒、逆转录病毒、细菌、真菌、酵母和支原体检测。人类和动物衍生试剂在使用前经过人类和动物病毒、细菌、真菌和支原体检测。然而,以上措施并不能消除传播这些或其他传染病或病原体的风险。
异位组织形成:由于人类间充质基质细胞(MSC)能够分化成间充质谱系细胞,如骨、软骨和脂肪细胞,因此使用本品治疗后可能会出现异位组织形成。
【Ryoncil特殊人群中的使用】
孕妇:不建议孕妇使用本品。目前尚无关于孕妇使用本品的可用数据。尚未对本品进行动物生殖和发育毒性研究,以评估孕妇使用本品后是否会对胎儿造成伤害。尚不清楚本品是否有可能被转移到胎儿体内。因此,不建议孕妇使用。
哺乳:目前尚无关于本品是否出现在人乳中、对母乳喂养婴儿的影响以及对产奶量的影响的信息。应考虑母乳喂养对发育和健康的益处,以及母亲对本品的临床需求以及本品或潜在母体疾病对母乳喂养婴儿的任何潜在不利影响。
儿科患者:本品治疗SR-GvHD的安全性和有效性已在2个月及以上的儿科患者中得到证实。
【Ryoncil一般描述及作用机制】
Ryoncil(remestemcel-L-rknd)是一种来自供体骨髓的间充质基质细胞(MSC)疗法。间充质干细胞是一类细胞,可以分化成多种其他类型的细胞,在体内发挥各种作用。
Ryoncil的作用机制被认为涉及免疫系统功能的改变,可能抑制T细胞激活(T细胞介导与急性GvHD相关的炎症、细胞损伤和器官损伤),但确切作用机制尚不清楚。
【Ryoncil患者资讯资料】
1. 告知患者或家属,由于猪和牛蛋白以及DMSO的存在,使用本品可能会出现过敏和急性输液反应。建议患者或家属如果出现任何过敏或急性输液反应的体征和症状,如发烧、皮疹或荨麻疹、低血压、呼吸问题等,应立即联系医护人员。详见(警告和注意事项)。
2. 告知患者或家属使用本品可能存在传播传染病或病原体的风险。详见(警告和注意事项)。
3. 告知患者或家属使用本品可能存在异位组织形成的风险。详见(警告和注意事项)。
【Ryoncil用药手册】
一、 Ryoncil的接收和存储
• 装在温度保持在≤- 135℃的液氮干货装运箱中运送到临床机构。
• 必须保持冷冻在≤- 135°C的液氮蒸汽相中,直到在给药前解冻。
二、 Ryoncil给药前准备
• Ryoncil和 Plasma-Lyte® A应在生物安全柜(BSC)中按照无菌技术进行制备。在将以下材料转移到BSC制备区之前,先用70%酒精喷洒并擦拭它们。所有材料应留在BSC准备区,除非被丢弃。
• 准备一个深度至少为4英寸的无菌水浴,并在解冻前至少30分钟加热至37°C(±2°C)。
• 准备Ryoncil和 Plasma-Lyte® A 所需的用品:
n Ryoncil小瓶
n Plasma-Lyte® A
n 输液袋
n Interlink血袋刺针 (2个)
n Interlink螺纹锁套管 (每个注射器1个)
n 60 mL luer-lock注射器 (1个)
n 5 mL luer-lock注射器 (每个解冻小瓶1个)
n 18号针头 (每个解冻小瓶1个) 。注意:如果要从小瓶中取出的体积少于1mL,请使用1mL注射器
n 密封拉链塑料袋 (每个小瓶1个用于解冻)
n 水浴
n 酒精湿巾
注:Plasma-Lyte® A可以用Plasma-Lyte® 148(pH值为7.4,不含葡萄糖)替代。
• Plasma-Lyte® A 的制备
1. 将Interlink血袋刺针插入Plasma-Lyte® A袋。
2. 在无菌条件下将螺纹锁套管连接到60mL注射器上。
3. 使用酒精湿巾擦洗Plasma-Lyte® A袋互联针注射部位的膜。将带螺纹的锁定套管或注射器组件连接到Plasma-Lyte® A袋的注射部位。
4. 从袋中量取40mL Plasma-Lyte® A。注意:不要将装有Plasma-Lyte® A的注射器从Plasma-Lyte® A袋中取出。将其放在一边以备后用。
• Ryoncil的制备
5. 在Ryoncil解冻之前,确认预先安排的给药时间仍然可行。因为患者输液必须在Ryoncil第一瓶解冻后的5小时内进行。
6. 从冷冻储藏室中取出Ryoncil小瓶。
7. 将小瓶放入密封的塑料袋中,然后将密封的袋子浸入水浴(37ºC)中,保持顶部封口在水位线以上。每瓶都使用单独的密封塑料袋。注意:水浴中最多可同时解冻4个小瓶。
8. 请将密封的拉链密封袋与小瓶一起轻轻搅动约5至8分钟以解冻。
9. 在最后一块可见的冰晶体融化之前将小瓶从水浴中取出。注意:每组四个小瓶间隔不要超过15分钟。
10. 检查袋中的小瓶,确认小瓶内容物没有泄漏。
11. 从密封的塑料袋中取出小瓶。
12. 检查是否有异物颗粒(FPM)。如果目视检查发现有 FPM – 请勿使用!保留有问题的小瓶,并联系厂家。
13. 用70%酒精擦拭小瓶和顶盖。擦去多余的液体。
14. 立即从药瓶中抽取所需剂量的Ryoncil(根据患者实际体重)。每个解冻药瓶需要一个注射器和一个18号针头。
15. 小心地从装有Ryoncil的注射器中取出针头。
16. 将螺纹锁套管连接到注射器上。
17. 取出输液袋。
18. 用无菌酒精擦拭输液袋互联针注射部位的膜。
19. 将1个interlink血袋刺针插入输液袋的最外端口(将中间端口留作输液管线)。
20. 将注射器连接到针头上,并将Ryoncil转移到输液袋中。
21. 取下带有螺纹锁紧套管的注射器,并丢弃注射器和螺纹锁紧套管。
22. 对每个注射器重复上述操作,直到所需量的Ryoncil添加到输液袋中。
• 将 Plasma-Lyte® A 转移到输液袋中
1. 取出装有 Plasma-Lyte® A的袋子和60mL注射器。
2. 确认注射器中含有40mL Plasma-Lyte® A。
3. 在无菌条件下,从Plasma-Lyte® A袋中取出装有40mL Plasma-Lyte® A的60mL带螺纹锁套管的注射器。
4. 用酒精湿巾清洁输液袋互联针注射部位的膜。
5. 无菌条件下,将装有Plasma-Lyte® A的60mL注射器连接至输液袋。
6. 将40mL Plasma-Lyte® A缓慢转移到输液袋中。
7. 将细胞与Plasma-Lyte® A轻轻混合。
8. 取出带有螺纹锁套管的注射器,并丢弃注射器和螺纹锁套管。
9. 根据机构政策给输液袋贴上标签。
10. 将输液袋运送至患者输液区。
三、 给药注意事项:患者输液必须在第一瓶Ryoncil解冻后5小时内进行。
应在具有SR-aGvHD管理经验的医护人员的监督下使用Ryoncil。
使用输液泵注射。
使用孔径为40-260微米的血液过滤器输注。
按照机构实践和细胞输注政策冲洗管线。
• 预处理:在输注Ryoncil前30-60分钟,预先给患者使用皮质类固醇和抗组胺药,以减少潜在的输液反应。
• 输注速率:
n 对于体重35kg或以上的患者,输注速率不超过6mL/min。
n 对于体重低于35kg的患者,输注时间在60分钟以上。
• 按照机构政策丢弃未使用的、解冻的Ryoncil小瓶。
信息来源:
[1]https://www.ryoncil.com/pdfs/prescribing-information.pdf?1
[2]https://www.fda.gov/news-events/press-announcements/fda-approves-first-mesenchymal-stromal-cell-therapy-treat-steroid-refractory-acute-graft-versus-host
注:以上说明书为高等医药院校的学生志愿者翻译(如有错漏,请帮忙指正),仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。





