2024年12月20日,Vertex Pharmaceuticals(福泰制药)宣布美国食品药品监督管理局(FDA)批准Alyftrek每日口服一次,用于治疗6岁及以上囊性纤维化(CF) 患者,这些患者CFTR基因中至少有一种(F508del突变或其他CFTR基因应答性突变)对Alyftrek有缓解的突变。
【生产企业】:Vertex Pharmaceuticals(福泰制药)
【规格】:①4mg Alyftrek固定剂量复合剂:含vanzacaftor 4mg、tezacaftor 20mg和deutivacaftor 50mg。②10mg Alyftrek固定剂量复合剂:含vanzacaftor 10mg、tezacaftor 50mg和deutivacaftor 125mg。
【商标】:Alyftrek
【通用名】:vanzacaftor, tezacaftor and deutivacaftor
【性状】:①4mg Alyftrek固定剂量复合剂:含vanzacaftor 4mg、tezacaftor 20mg和deutivacaftor 50mg。每片为紫色、圆形、薄膜包衣片,一面压印“V4”,另一面空白。②10mg Alyftrek固定剂量复合剂:含vanzacaftor 10mg、tezacaftor 50mg和deutivacaftor 125mg。每片药片为紫色、长方形、薄膜包衣,一面压印“V10”,另一面空白。
【贮藏】:原包装储存在室温20ºC - 25ºC(68ºF - 77ºF);允许短暂储存在15ºC - 30ºC(59ºF - 86ºF)。
【Alyftrek适应症和用途】
Alyftrek适用于治疗至少有一个F508del突变或另一个CFTR基因应答性突变的6岁及以上囊性纤维化(CF)患者。
如果患者的基因型未知,则应使用FDA批准的CF突变测试来确认存在至少一种指示突变。
【Alyftrek用法用量】
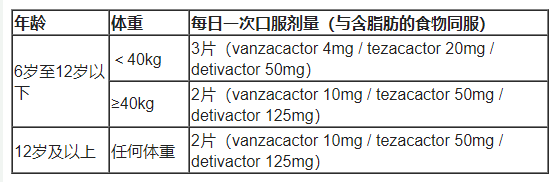
每日一次,在每日同一时间服用Alyftrek(将药片整个吞下),与含脂肪的食物一起服用。表1列出了成人和6岁及以上儿科患者的推荐剂量。含有脂肪的正餐或零食包括用黄油或油制成的正餐或含有鸡蛋、花生酱、奶酪、坚果、全脂牛奶或肉类的正餐或零食。
在开始Alyftrek治疗之前,应对所有患者进行肝功能检查(ALT、AST、碱性磷酸酶和胆红素)。在治疗的前6个月内每月监测一次肝功能检查,然后在接下来的12个月内每3个月监测一次,之后至少每年监测一次。
一、成人及6岁及以上儿科患者推荐剂量
表1. 成人及6岁及以上儿科患者推荐用量
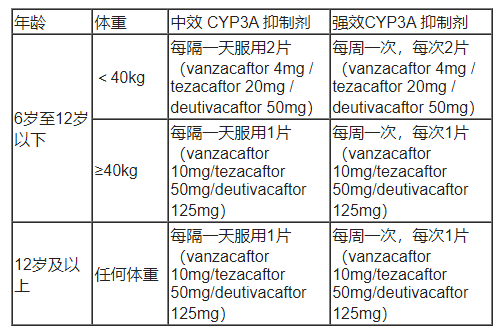
 二、强效或中效CYP3A抑制剂的剂量调整
二、强效或中效CYP3A抑制剂的剂量调整
表2. 成人和6岁及以上的儿科患者
同时使用Alyftrek与强效或中效CYP3A抑制剂的剂量调整
三、肝功能不全患者的推荐剂量:①肝功能严重受损的患者不应使用。②不建议中度肝功能受损的患者使用,只有当有明确的医疗需求且益处大于风险时,才应考虑对中度肝功能不全患者使用。如果使用,剂量应与肝功能正常的患者相同,同时应密切监测肝功能检查指标。③轻度肝功能不全患者的推荐剂量与肝功能正常的患者相同。
四、漏服剂量的建议:如果距漏服剂量已过去6小时或更短时间,请尽快服用漏服剂量并继续按照原计划服药。如果距漏服剂量已超过6小时,则跳过漏服剂量,并在第二天继续按原计划服药。
【Alyftrek禁忌症】
无。
【Alyftrek不良反应】
最常见的不良反应(≥5%的患者,且发生率比ELX/TEZ/IVA高≥1%)是咳嗽、鼻咽炎、上呼吸道感染、头痛、口咽痛、流感、疲劳、 ALT升高、皮疹、 AST升高和鼻窦充血。
【Alyftrek警告和注意事项】
药物引起的肝损伤和肝功能衰竭:接受本品治疗的患者中观察到转氨酶升高。据报道,使用含有与Alyftrek相同或相似活性成分的药物会导致严重且可能致命的药物引起的肝损伤和肝功能衰竭。在开始使用本品之前及整个治疗过程中,应对所有患者进行肝功能检查(ALT、AST、碱性磷酸酶和胆红素)。如果肝功能检查指标显著升高或出现肝损伤的体征或症状,请中断服用:①肝功能检查指标显著升高(如,ALT或AST >5 倍上限或正常值(ULN)或ALT或AST >3倍 ULN,胆红素 >2倍ULN)。②提示肝损伤的临床体征或症状(例如,黄疸、右上腹疼痛、恶心、呕吐、精神状态改变、腹水)。出现以上症状,应考虑转诊给肝病专家,并通过临床和实验室监测密切跟踪患者,直到异常情况消失。如果异常情况消失,并且预计收益大于风险,则在密切监测下恢复 服用本品治疗。重度肝功能不全(Child-Pugh C级)患者不应服用本品。不建议中度肝功能不全(Child-Pugh B级)患者服用本品。
过敏反应:含有 elexacaftor、tezacaftor 和/或 ivacaftor 的药物(与本品的活性成分相同或相似)上市后曾报告出现过敏反应。如果在服用本品治疗期间出现严重过敏反应的体征或症状,应停止服用本品并联系医护人员开始适当的治疗。之后再充分衡量个体患者的益处和风险,以确定是否恢复服用本品治疗。
曾因不良反应而停用或中断含Elexacaftor、Tezacaftor或Ivacaftor药物的患者:因不良反应而停用或中断含elexacaftor、tezacaftor或Ivacaftor药物的患者在服用本品前应充分考虑其益处和风险。如果考虑服用本品,应根据临床情况密切监测不良反应。
与CYP3A诱导剂同时使用的患者疗效降低:与强效和中效CYP3A诱导剂同时使用会降低vanzacaftor、tezacaftor和deutivacaftor的暴露量,这可能会降低本品的疗效。因此,不建议同时使用。
与CYP3A抑制剂同时使用时产生的不良反应:与强效或中效CYP3A抑制剂同时使用会增加vanzacaftor、tezacaftor和deutivacaftor的暴露量,这可能会增加相关不良反应的风险。同时使用时应减少本品的剂量,剂量调整请参阅【用法用量】表2。
白内障:据报道,使用含ivacaftor药物治疗的18岁或以下上囊性纤维化(CF)患者会出现非先天性晶状体混浊/白内障。建议对服用本品治疗的儿科患者进行基线和随访眼科检查。
【Alyftrek药物相互作用】
其他药物和葡萄柚对Alyftrek的影响:
1. 强效或中效CYP3A诱导剂:不建议与本品同时使用。
2. 强效或中效CYP3A抑制剂:同时使用时减少本品剂量,具体剂量调整请参阅【用法用量】表2。
3. 葡萄柚:在服用本品治疗期间,应避免食用含有葡萄柚的食物或饮料。本品与含有一种或多种中度抑制CYP3A成分的葡萄柚汁同时使用可能会增加vanzacaftor、tezacaftor 和 deutivacaftor 的暴露量。
Alyftrek对其他药物的影响:
4. P-糖蛋白(P-gp)底物:除非P-gp底物处方信息中另有建议,否则应更频繁地监测本品与P-gp底物同时使用时的不良反应,因为最小的浓度变化都可能导致与 P-gp底物相关的严重不良反应。Tezacaftor和deutivacaftor(本品的活性成分)是P-gp抑制剂。使用Tezacaftor/ivacaftor会增加P-gp底物的暴露量,这可能会增加与这些底物相关的不良反应的风险。
5. 乳腺癌耐药蛋白(BCRP)底物:除非BCRP底物处方信息中另有建议,否则应更频繁地监测本品与BCRP底物同时使用时的不良反应,因为最低浓度可能会导致与BCRP底物相关的严重不良反应。由于Vanzacaftor和deutivacaftor (本品活性成分)是体外BCRP的抑制剂,虽然尚未进行临床研究,但本品与BCRP底物同时使用可能会增加这些底物的暴露量。
6. CYP2C9底物:本品与CYP2C9底物同时使用时应谨慎。本品与华法林同时使用时,应更频繁地监测国际标准化比率 (INR)。以上该建议是基于deutivacaftor(本品活性成分)是体外CYP2C9的抑制剂,虽然尚未进行临床研究,但本品与CYP2C9底物同时使用可能会增加这些底物的暴露量。
与Alyftrek无临床显著相互作用的药物
1. 环丙沙星:tezacaftor/ivacaftor与环丙沙星同时使用时,未观察到对tezacaftor暴露的临床相关影响。
2. 激素避孕药:含炔雌醇/炔诺酮的激素避孕药与tezacaftor联合使用、ivacaftor联合使用和单独使用ivacaftor时,药代动力学无明显临床差异。注意:不排除激素避孕药导致皮疹的可能性,对于服用激素避孕药并出现皮疹的CF患者,请考虑中断本品和激素避孕药。皮疹消退后,考虑在不使用激素避孕药的情况下恢复服用本品;如果皮疹没有复发,可以考虑恢复使用激素避孕药。
【Alyftrek特殊人群中的使用】
孕妇:目前尚无本品在孕妇中使用的数据来评估与药物相关的重大出生缺陷、流产或其他不良母婴结局的风险。
哺乳:目前尚无关于vanzacaftor、tezacaftor、deutivacator或其代谢物在母乳中的存在、对母乳喂养婴儿的影响或对乳汁产量影响的数据。
儿科患者:本品对至少有一个F508del突变或另一个CFTR基因应答性突变的6岁及以上囊性纤维化(CF)患者的安全性和有效性已得到证实。目前尚不清楚本品对6岁以下儿童是否安全有效。
老年患者:临床研究尚未纳入足够数量的65岁及以上的CF患者,因此无法确定他们的反应是否与年轻成年CF患者不同。
肾功能损伤:轻度至中度肾功能损伤(RI)的CF患者(eGFR 30 ~ < 90mL/min/1.73m2)的推荐剂量与肾功能正常的CF患者相同;只有在预期获益大于风险的情况下,才推荐对伴有严重RI (eGFR <30mL/min/1.73m2)或终末期肾病的CF患者服用本品。
肝功能损伤:①严重肝功能损伤(HI)患者:不应用于严重肝功能损害(HI)患者。②中度肝功能损伤(HI)患者:不建议服用,只有在预期获益大于风险的情况下,才考虑对中度HI患者服用本品;如果服用,中度HI患者的推荐剂量与肝功能正常患者相同,并同时密切监测肝功能指标。③:轻度肝功能损伤(HI)患者:推荐剂量与肝功能正常患者相同。
【Alyftrek一般描述及作用机制】
Alyftrek (vanzacaftor, tezacaftor and deutivacaftor)是一种每日一次的三联组合囊性纤维化跨膜传导调节因子(CFTR)调节剂。Vanzacaftor和tezacaftor与CFTR蛋白上的不同位点结合,并在促进CFTR(包括F508del-CFTR)的选择突变形式的细胞加工和运输中具有累加效应,与任一单独分子相比,增加了递送至细胞表面的CFTR蛋白的量。Deutivacaftor可增强细胞表面CFTR蛋白通道开放概率。三种成分的联合作用是增加细胞表面CFTR的数量和功能,导致CFTR活性增加,这通过CFTR介导的体外氯化物转运和患者的汗液氯化物来衡量。
【患者资讯资料】
1. 告知患者严格遵照医嘱用药。告知患者与含脂肪的食物一起服用时人体吸收效果最佳,例如鸡蛋、黄油、花生酱、全脂乳制品(如全脂牛奶、奶酪和酸奶)等。
2. 忠告患者有以上任何不良反应的症状应立即联系医护人员。
3. 告知患者在开始服用本品之前应评估肝功能,在治疗的前6个月内每月监测一次肝功能检查,然后在接下来的12个月内每3个月监测一次,之后至少每年监测一次。告知有肝病史或基线时肝功能检查指标升高的患者,可能需要更频繁地进行监测。
4. 告知患者如果出现肝损伤症状(例如黄疸、右上腹疼痛、恶心、呕吐、精神状态改变、腹水),应中断服用本品治疗,并立即联系医护人员,详见【警告与注意事项】。
5. 告知患者如果出现过敏反应的体征和症状,包括皮疹、荨麻疹、瘙痒、面部肿胀、胸闷和喘息,应中断服用本品治疗,并立即联系医护人员,详见【警告与注意事项】。
6. 告知患者,对于之前因不良反应而停止或中断使用含elexacaftor、tezacaftor或ivacaftor药物治疗的患者,目前尚无关于服用本品的安全性数据。这些患者开始使用本品治疗时可能需要更密切和更频繁的监测临床体征。
7. 忠告患者应主动告知正在使用的其他任何药物,包括处方药、非处方药等。
8. 告知患者在服用本品治疗时,应避免食用或饮用含有葡萄柚的食物或饮料。
9. 告知患者,部分接受含有ivacaftor(与本品的活性成分类似)药物的儿科患者已发现眼晶状体异常(即白内障),因此接受本品治疗的儿科患者需要进行基线和随访眼科检查。
信息来源:
[1]https://pi.vrtx.com/files/uspi_vanzacaftor_tezacaftor_deutivacaftor.pdf
注:以上说明书为高等医药院校的学生志愿者翻译(如有错漏,请帮忙指正),仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。