2024年12月13日,Checkpoint Therapeutics宣布,美国食品药品监督管理局FDA已批准Unloxcyt(cosibelimab-ipdl,柯希利单抗)用于治疗转移性皮肤鳞状细胞癌(cSCC)或不适合治愈性手术或放疗的局部晚期cSCC成年患者。Unloxcyt是首个也是唯一一个获得FDA批准用于此适应症的程序性死亡配体-1(PD-L1)阻断抗体。
【生产企业】:Checkpoint Therapeutics公司
【规格】:300mg/5mL(60mg/mL)/瓶
【商标】:Unloxcyt
【通用名】:cosibelimab-ipdl
【中文名】:柯希利单抗
【性状】:本品呈透明至乳白色,无色至黄色或浅棕色溶液。
【贮藏】:原包装盒置于2°C至8°C (36°F至46°F) 冰箱中避光保存。请勿冷冻或摇晃。
【Unloxcyt适应症和用途】
Unloxcyt适用于治疗转移性皮肤鳞状细胞癌(cSCC)或不适合治愈性手术或放疗的局部晚期cSCC成年患者。
【Unloxcyt用法用量】
• 推荐剂量为1200mg,每3周静脉输注60分钟,直到病情恶化或出现不可接受的毒性。
• 剂量调整:不建议减少本品的剂量。一般来说,对于严重(3级)免疫介导不良反应,应暂停使用。如果出现危及生命的(4级)免疫介导不良反应、复发性严重(3级)免疫介导不良反应且需要全身免疫抑制治疗,或在开始类固醇治疗的12周内无法将皮质类固醇剂量减少到相当于每天10mg或更少的泼尼松,应永久停用本品。
表1总结了与一般指南不同的管理方式,关于不良反应的剂量调整。
表1、针对不良反应的推荐剂量调整
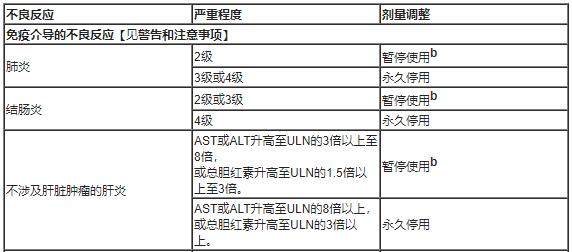
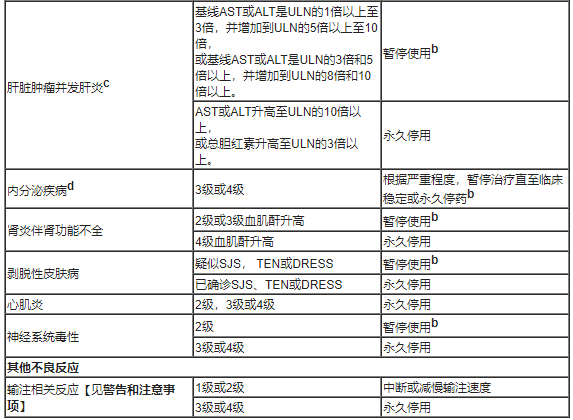 b:皮质类固醇减量后,完全或部分缓解(0至1级)的患者可恢复用药。如果在开始使用类固醇后12周内未完全或部分缓解,或者在开始使用类固醇后12周内无法将皮质类固醇减量至相当于每天10mg或更少的泼尼松,则永久停用。
b:皮质类固醇减量后,完全或部分缓解(0至1级)的患者可恢复用药。如果在开始使用类固醇后12周内未完全或部分缓解,或者在开始使用类固醇后12周内无法将皮质类固醇减量至相当于每天10mg或更少的泼尼松,则永久停用。
c:如果肝脏肿瘤并发肝炎患者的基线AST和ALT小于或等于ULN,则根据不涉及肝脏肿瘤的肝炎的建议,暂停或永久停用。
d:根据临床严重程度, 对于2级内分泌病的不良反应患者,考虑暂停使用,直至通过激素替代疗法改善症状。急性症状消退后恢复治疗。
【Unloxcyt用药指南】
目视检查药瓶中是否有颗粒物和变色:本品应呈透明至乳白色,无色至黄色或浅棕色。如果目视发现可见颗粒,请丢弃药瓶。注意不要摇晃药瓶。
• 配制输注溶液:
1. 将20mL (1200mg) 本品加入含有0.9%氯化钠注射液的250mL静脉输注袋中。本品与聚烯烃或聚氯乙烯制成的输液袋兼容。
2. 轻轻倒置混合稀释溶液。切勿摇晃。
3. 丢弃药瓶中剩余的任何未使用部分。
• 输注溶液的储存:配制好的输注溶液可以储存在:
1. 室温25°C(77°F)下,从配制到输液结束不超过24小时。
2. 从配制到输注结束,在2°C至8°C(36°F至46°F)的温度下冷藏,时间不超过24小时。如果冷藏,则在给药前让稀释溶液恢复至室温。
3. 如果超过24小时,请丢弃。
4. 请不要冷冻。
• 输液给药:
1. 输液前目视检查输液袋中是否有颗粒物和变色。如果溶液变色或含有颗粒物,请丢弃。
2. 通过含有0.2微米至0.22微米的无菌、在线或附加过滤器的静脉管线,在60分钟内通过静脉输注给药。
3. 请勿通过静脉推注或推注的方式给药。
4. 请勿通过同一输液管同时输注其他药物。
【Unloxcyt禁忌症】
无。
【Unloxcyt不良反应】
最常见的不良反应(≥10%)是疲劳、肌肉骨骼疼痛、皮疹、腹泻、甲状腺功能减退、便秘、恶心、头痛、瘙痒、水肿、局部感染和尿路感染。
【Unloxcyt警告和注意事项】
• 严重和致命的免疫介导的不良反应
①免疫介导的不良反应可发生在任何器官系统或组织中,包括以下情况:免疫介导的肺炎、免疫介导的结肠炎、免疫介导的肝炎、免疫介导的内分泌病、免疫介导的皮肤不良反应、免疫介导的肾炎和肾功能障碍以及实体器官移植排斥反应。
②为了确保安全使用PD-1/PD-L1阻断抗体,应尽早识别和管理免疫介导的不良反应。密切监测可能的潜在免疫介导不良反应的临床症状和体征。在治疗基线和治疗期间定期评估肝酶、肌酐和甲状腺功能。如果疑似存在免疫介导不良反应,应进行适当的检查以排除其他病因,包括感染。及时进行医疗管理,包括酌情进行专科会诊。
③根据严重程度暂停或永久停用【见用法用量】。一般来说,如果需要暂停或永久停用本品,则使用全身性皮质类固醇(1至2mg/kg/天泼尼松或等效剂量)直至改善至1级或以下。改善至1级或以下后,开始逐渐减少皮质类固醇用量,维持至少1个月。对于使用皮质类固醇无法控制免疫介导的不良反应的患者,可考虑使用其他全身性免疫抑制剂。
④以下是不一定需要使用全身性类固醇的不良反应(如内分泌疾病、皮肤反应)的管理指南:
1)免疫介导的肺炎:在使用其他 PD-1/PDL1 阻断抗体治疗的患者中,接受过胸部放射治疗的患者发生肺炎的几率更高。
2)免疫介导性结肠炎:症状可能表现为腹泻、腹痛和下消化道 (GI) 出血。对于皮质类固醇难治性结肠炎,请考虑重复感染检查以排除其他病因。
3)免疫介导性肝炎:需要使用全身性皮质类固醇且没有明确的其他病因。
4、免疫介导的内分泌病:
1) 肾上腺功能不全:可导致原发性或继发性肾上腺功能不全。对于 2 级或更高级别的肾上腺功能不全,请参照医疗机构的指南开始对症治疗,包括根据临床指征进行激素替代治疗。根据严重程度暂停或永久停用。局部润肤剂和/或局部皮质类固醇可能足以治疗轻度至中度非大疱性/剥脱性皮疹。根据严重程度暂停或永久停用本品。
2) 垂体炎:可出现与肿块效应相关的急性症状,如头痛、畏光或视野缺损。 垂体炎可导致垂体功能减退。根据临床指征开始激素替代治疗。根据严重程度暂停或永久停用本品。
3) 甲状腺疾病:可导致免疫介导的甲状腺疾病。甲状腺炎可伴有或不伴有内分泌失调。甲状腺功能亢进后可出现甲状腺功能减退。根据临床指征开始激素替代或甲状腺功能亢进的药物治疗。根据严重程度暂停或永久停用本品。若出现甲状腺功能亢进症状,应监测患者是否出现高血糖或其他糖尿病体征和症状。根据临床指征开始使用胰岛素治疗。根据严重程度暂停或永久停用本品。
5、伴有肾功能障碍的免疫介导性肾炎:需要使用全身性皮质类固醇且没有明确的其他病因。
6、免疫介导的皮肤不良反应:可引起免疫介导的皮疹或皮炎。大疱性和剥脱性皮炎,包括 Stevens-Johnson 综合征 (SJS)、中毒性表皮坏死松解症 (TEN) 以及伴有嗜酸性粒细胞增多和全身症状的药疹(DRESS)。
7、其他免疫介导的不良反应:
1) 心脏/血管:心肌炎、心包炎、血管炎。
2) 神经系统:脑膜炎、脑炎、脊髓炎和脱髓鞘、肌无力综合征/重症肌无力(包括恶化)、格林-巴利综合征、神经麻痹、自身免疫性神经病。
3) 眼部:葡萄膜炎、虹膜炎、其他眼部炎症毒性。有些病例可能与视网膜脱落有关。可能会出现包括失明在内的各种程度的视觉障碍。如果葡萄膜炎与其他免疫介导的不良反应同时发生,请考虑VogtKoyanagi-Harada样综合征,可能需要全身性类固醇治疗,以降低永久性视力丧失的风险。
4) 胃肠道:胰腺炎,包括血清淀粉酶和脂肪酶水平升高、胃炎、十二指肠炎。
5) 肌肉骨骼和结缔组织:肌炎/多发性肌炎、横纹肌溶解症和相关后遗症,包括肾衰竭、关节炎、风湿性多肌痛。
6) 内分泌:甲状旁腺功能低下。
7) 其他(血液学/免疫):自身免疫性溶血性贫血、再生障碍性贫血、噬血细胞性淋巴组织细胞增生症、全身炎症反应综合征、组织细胞坏死性淋巴结炎(Kikuchi淋巴结炎)、结节病、免疫性血小板减少症、实体器官移植排斥、其他移植(包括角膜移植)排斥。
• 输液相关反应:本品可能引起严重或危及生命的输液相关反应。应监测患者是否出现输液相关反应的体征和症状。并根据反应的严重程度,选择中断、减慢输液速度或永久停用本品【见用法用量】。对于之前对治疗性蛋白质输液有全身反应的患者,考虑预先使用解热药或抗组胺药。
• 同种异体造血干细胞移植(HSCT)的并发症:对于在接受PD-1/PDL1阻断抗体治疗之前或之后接受同种异体造血干细胞移植的患者,可能发生致命和其他严重的并发症。移植相关并发症包括超急性移植物抗宿主病(GVHD)、急性GVHD、慢性GVHD、降低强度预处理后的肝小静脉闭塞性疾病和类固醇需求性发热综合征(没有明确的感染原因)。应密切监测患者是否有移植相关并发症的症状并及时干预。充分考虑使用本品治疗的益处与风险。
• 胚胎-胎儿毒性:根据其作用机制,孕妇使用本品可能会对胎儿造成伤害。告知育龄女性本品对胎儿的潜在风险,并建议在本品治疗期间以及最后一次给药后 4个月内采取有效的避孕措施。
【Unloxcyt特殊人群中的使用】
• 孕妇:根据其作用机制,给孕妇使用本品可能会对胎儿造成伤害。告知育龄女性对胎儿的潜在风险,在开始治疗前确认女性的妊娠状况,建议在本品治疗期间以及最后一次给药后4个月内采取有效的避孕措施。
• 哺乳:目前尚无关于本品是否出现在人乳汁中或对母乳喂养婴儿或产奶量的影响的数据。由于母乳喂养婴儿可能出现严重不良反应,建议女性在本品治疗期间以及最后一次给药后4个月内不要进行母乳喂养。
• 儿科患者:尚未确定本品对儿科患者的安全性和有效性。
• 老年患者:在已有的临床研究中,老年患者与年轻患者在安全性或有效性方面无总体差异。
【Unloxcyt一般描述及作用机制】
cosibelimab-ipdl是一种完全人源化、具有高亲和力的单克隆抗体,可直接与PD-L1结合,从而阻断其与PD-1以及B7.1受体的相互作用,进而除去PD-L1对CD8+ T细胞的抑制效果,恢复其毒杀性T细胞反应。此外,还可在体外诱导抗体依赖性细胞介导的细胞毒性 (ADCC)。
【Unloxcyt患者资讯资料】
1. 告知患者使用本品可引起免疫介导的不良反应,可能需要使用皮质类固醇治疗及中断或永久停用,详见(Unloxcyt警告和注意事项)。
2. 忠告患者有以上任何不良反应的症状应立即联系医护人员。
3. 告知育龄女性使用本品对胎儿的潜在风险,在开始治疗前确认女性的妊娠状况,建议患者在本品治疗期间以及最后一次给药后4个月内采取有效的避孕措施。
4. 建议女性患者在本品治疗期间以及最后一次给药后4个月内不要进行母乳喂养。
信息来源:
[1]https://checkpointtx.com/wp-content/uploads/2024/12/uspi-unloxcyt.pdf
[2]https://www.globenewswire.com/news-release/2024/12/13/2997087/36989/en/Checkpoint-Therapeutics-Announces-FDA-Approval-of-UNLOXCYT-cosibelimab-ipdl.html
注:以上说明书为高等医药院校的学生志愿者翻译(如有错漏,请帮忙指正),仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。





