2024年12月13日,Neurocrine Biosciences宣布,美国食品药品监督管理局FDA已批准Crenessity(crinecerfont)胶囊和口服溶液作为糖皮质激素替代的辅助治疗,用于控制患有典型先天性肾上腺增生症(CAH)的成人和4岁及以上儿科患者的雄激素。Crinecerfont是一种强效、选择性的口服促肾上腺皮质激素释放因子(CRF)1型受体拮抗剂,可在不阻断CRF2型受体结合的情况下阻断CRF与垂体中的CRF1型受体结合,进而抑制垂体分泌促肾上腺皮质激素(ACTH),从而减少ACTH介导的肾上腺雄激素生成。
这是首个也是唯一一个专门针对典型先天性肾上腺增生症治疗方法,可直接减少过量促肾上腺皮质激素和下游肾上腺雄激素的产生,从而减少糖皮质激素的剂量。
【生产企业】:Neurocrine Biosciences(神经分泌生物科学)
【规格】:① 胶囊:25mg*60粒/盒,50mg*60粒/盒,100mg*60粒/盒。 ②口服液:50mg/mL。
【商标】:Crenessity
【通用名】:crinecerfont
【性状】:①胶囊:25mg:椭圆形橙色软明胶胶囊,以黑色墨水印有“WWV 25”字样;50mg:椭圆形、双色(橙色和金色)软明胶胶囊,以黑色墨水印有“WWV 50”字样;100mg:长方形金色软明胶胶囊,以黑色墨水印有“WWV 100”字样。②口服液:呈淡黄色至橙色,透明至微乳白色的溶液。
【贮藏】:
①胶囊:储存在15°C至25°C(59°F至77°F)的温度。不要冷冻。②口服溶液:在原容器中储存和分配。应直立存放,不要冻结。将未开封的瓶子储存在2°C至8°C(36°F至46°F)中。开瓶使用后,可在2°C至8°C或室温(15°C至25°C)下储存30天;首次开瓶30天后,丢弃任何未使用的口服液。
【Crenessity适应症和用途】
Crenessity作为糖皮质激素替代的辅助治疗,用于控制患有典型先天性肾上腺增生症(CAH)的成人和4岁及以上儿科患者的雄激素。
【Crenessity用法用量】
• 成人:每天两次,每次口服100mg,早晚随餐服用。
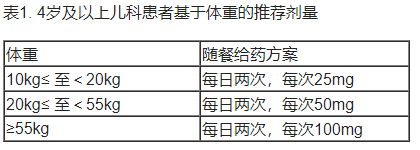
• 儿科患者(4岁及以上):根据体重计算相应剂量,每天口服两次,早晚随餐服用。
【Crenessity用药管理】
1. 重要管理信息
• 接受Crenessity治疗的患者应继续接受糖皮质激素替代治疗,治疗与先天性肾上腺增生相关的肾上腺功能不全,见【Crenessity警告和注意事项】。
• 在服用Crenessity四周后开始评估雄烯二酮水平,以根据临床指征减少糖皮质激素剂量。请勿将糖皮质激素剂量降低至替代疗法所需的剂量以下。
2. 推荐剂量和用法
• 成人:每天两次,每次口服100mg,早晚随餐服用。
• 儿科患者(4 岁及以上):根据体重计算相应剂量,每天口服两次,早晚随餐服用,见表1。
 3. 与强CYP3A4诱导剂合用时的剂量调整
• 成人:当与强CYP3A4诱导剂同时使用时,将本品的口服剂量增加至200mg,每日两次,早晚随餐服用。
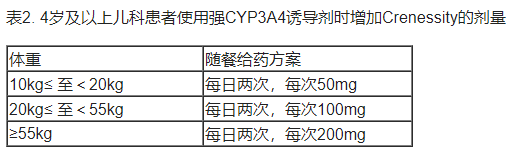
• 儿科患者(4岁及以上):当与强CYP3A4诱导剂同时使用时,在早晚进餐时需增加本品的剂量,如表2所示。
3. 与强CYP3A4诱导剂合用时的剂量调整
• 成人:当与强CYP3A4诱导剂同时使用时,将本品的口服剂量增加至200mg,每日两次,早晚随餐服用。
• 儿科患者(4岁及以上):当与强CYP3A4诱导剂同时使用时,在早晚进餐时需增加本品的剂量,如表2所示。
 4. 与中度CYP3A4诱导剂合用时的剂量调整
• 成人:与中等 CYP3A4 诱导剂同时使用时,晚餐需将本品剂量增加至200mg,随餐服用。早餐时服用100mg的剂量保持不变。
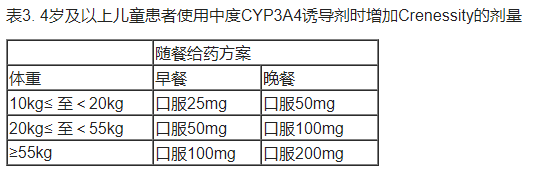
• 儿科患者(4 岁及以上):当与中度CYP3A4诱导剂同时使用时,需要在晚餐时增加本品的剂量,如表3所示。
4. 与中度CYP3A4诱导剂合用时的剂量调整
• 成人:与中等 CYP3A4 诱导剂同时使用时,晚餐需将本品剂量增加至200mg,随餐服用。早餐时服用100mg的剂量保持不变。
• 儿科患者(4 岁及以上):当与中度CYP3A4诱导剂同时使用时,需要在晚餐时增加本品的剂量,如表3所示。
 5. 给药说明:随餐服用,早晚餐各口服一次。
• 胶囊:口服,用液体整个吞服。
• 口服溶液:第一次开瓶30天后,请丢弃任何未使用的口服液。见【储藏】。
5. 给药说明:随餐服用,早晚餐各口服一次。
• 胶囊:口服,用液体整个吞服。
• 口服溶液:第一次开瓶30天后,请丢弃任何未使用的口服液。见【储藏】。
6. 错过剂量:如果错过了一剂或多剂,建议患者尽快服用一剂 (即使是在下一剂预定剂量之前),然后恢复常规给药计划。
【Crenessity禁忌症】
本品禁用于已知对本品及任何其他辅料过敏者。
【Crenessity不良反应】
• 成人:最常见的不良反应是疲劳、头痛、头晕、关节痛、背痛、食欲不振和肌痛。
• 儿科患者(4 岁及以上):最常见的不良反应是头痛、腹痛、疲劳、鼻塞和鼻出血。
【Crenessity警告和注意事项】
• 过敏反应:
包括喉咙紧绷、血管性水肿和全身皮疹。如果出现临床显著的过敏反应,请立即开始进行适当的对症治疗并停止服用本品。
• 伴随糖皮质激素治疗不足导致急性肾上腺功能不全或肾上腺危象的风险:
①在开始服用Crenessity时和治疗期间继续使用糖皮质激素。不要将糖皮质激素剂量降低到皮质醇替代所需的剂量以下。
②急性肾上腺功能不全或肾上腺危象可能会致命,可能发生于患有潜在肾上腺功能不全且每日糖皮质激素剂量不足的患者,尤其是在皮质醇需求增加的情况下,如急性并发疾病、严重创伤或外科手术。
③在开始服用Crenessity后,任何每日糖皮质激素剂量的调整都应在医护人员的监督下进行。在皮质醇需求增加的情况下(例如急性并发疾病、严重创伤、外科手术),请使用糖皮质激素应激剂量。
④在对患有典型CAH的成人进行的安慰剂对照临床研究中,Crenessity治疗组的肾上腺危象发生率为1.6%,安慰剂治疗组为0%。在对患有典型CAH的儿童受试者进行的安慰剂对照临床研究中,没有出现肾上腺危象事件。
【Crenessity药物相互作用】
本品是CYP3A4底物,如果与强或中等CYP3A4诱导剂同时使用会减少本品的暴露量,这可能会降低本品的疗效。因此,当与强或中等CYP3A4诱导剂同时使用时,应增加本品的服用剂量。详见【Crenessity用药管理】。
• 强效CYP3A4诱导剂:早晚剂量增加2倍。
• 中度CYP3A4诱导剂:晚间剂量增加2倍。
【Crenessity特殊人群中的使用】
• 怀孕:目前尚未确定怀孕期间服用本品是否与重大出生缺陷、流产或其他不良母体或胎儿结果的药物相关风险。如果在怀孕期间服用本品,或者患者在服用本品期间怀孕,请立即联系医护人员。
• 哺乳:目前尚无关于本品是否出现在人乳汁中或对母乳喂养婴儿或产奶量的影响的数据。建议充分考虑服用本品的风险与益处。
• 儿科患者:尚未确定本品对4岁以下儿科患者的安全性和有效性。
• 老年患者:在患有经典型CAH的成人中的临床试验中,没有招募65岁及以上的受试者,因为尚未能评估老年患者与年轻患者在安全性或有效性方面是否存在差异。
• 肾功能损害患者:对于严重肾功能损害或终末期肾病患者,不建议服用本品。
【Crenessity一般描述及作用机制】
Crinecerfont 是一种促皮质素释放因子1型受体拮抗剂,可以阻断垂体中CRF与CRF 1型受体的结合,但不阻断CRF 2型受体。与CRF型受体结合抑制垂体促肾上腺皮质激素(ACTH)分泌,从而减少ACTH介导的肾上腺雄激素产生。
【Crenessity患者资讯资料】
1. 告知患者严格遵照医嘱用药,必须早晚随餐服用。
2. 告知患者,如果他们正在服用强效或中效 CYP3A4 诱导剂,则需要增加Crenessity的剂量,详见【Crenessity用药管理】。
3. 告知患者如果出现超敏反应的迹象或症状,应立即就医。详见【Crenessity警告和注意事项】。
4. 忠告患者有以上任何不良反应的症状应立即联系医护人员。
5. 告知患者应在医护人员的指导下调整糖皮质激素剂量。
6. 告知患者应主动告知怀孕状态,如果在怀孕期间服用本品,或者患者在服用本品期间怀孕,请立即联系医护人员。
信息来源:
[1]https://pi.neurocrine.com/crenessity/CRENESSITY-Full-US-Prescribing-Information.pdf#page=17
[2]https://www.prnewswire.com/news-releases/fda-approves-new-treatment-for-congenital-adrenal-hyperplasia-302331755.html
注:以上说明书为高等医药院校的学生志愿者翻译(如有错漏,请帮忙指正),仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。






