Zenocutuzumab-zbco是一种双特异性抗体,它与细胞(包括肿瘤细胞)表面表达的HER2和HER3的胞外结构域结合,抑制HER2:HER3二聚化并防止NRG1与HER3结合;并且可通过磷酸肌醇3-激酶(PI3K)-AKT-哺乳动物雷帕霉素靶蛋白(mTOR)途径降低细胞增殖和信号传导。此外,zenocutuzumab-zbco介导抗体依赖性细胞毒性(ADCC),并在NRG1融合阳性肺癌和胰腺癌的小鼠模型中显示出抗肿瘤活性。
【生产企业】:Merus N.V.
【规格】:单剂量小瓶18.75mL中含375mg(20mg/mL)*2瓶/箱
【商标】:Bizengri
【通用名】:zenocutuzumab-zbco
【中文名】:泽妥珠单抗
【性状】:本品为透明至微乳白色、无色至微黄色溶液
【贮藏】:原包装储存在2°C至8°C(36°F至46°F)的冰箱中,避光保存。不要冻结。不要摇晃。
【Bizengri适应症和用途】
Bizengri适用于治疗携带NRG1基因融合(NRG1+)的晚期不可切除或转移性胰腺导管腺癌或非小细胞肺癌(NSCLC)成年患者,这些患者在接受既往全身治疗后出现疾病恶化的现象。
【Bizengri用法用量】
• 患者的选择:根据肿瘤标本中存在的NRG1基因融合体选择接受本品治疗的患者。注意,目前还没有FDA批准的检测NRG1基因融合的方法。
• 在开始使用前建议评估:左心室射血分数(LVEF)。
• 推荐剂量:推荐剂量为750mg,每2周静脉输注一次,直至疾病出现恶化或出现不可接受的毒性。
• 预先用药:在每次输液前按建议进行预用药,以减少输液相关反应的风险。
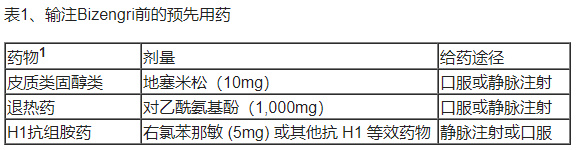 1初次输注后可选
1初次输注后可选
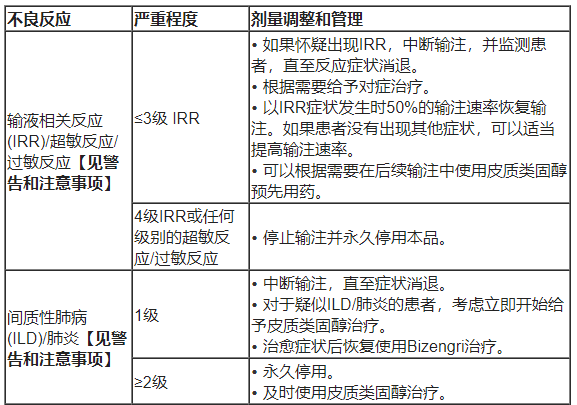
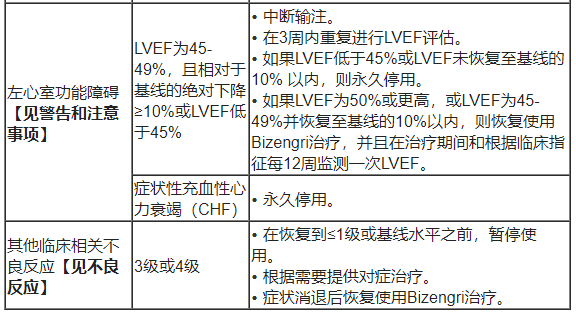
• 剂量调整:不建议减少Bizengri的剂量。表2、列出了针对不良反应的剂量调整建议。
表2. 推荐的Bizengri剂量调整和不良反应管理
• 具体用药方法请参阅文末【Bizengri用药管理】或查阅完整的处方信息。
【Bizengri禁忌症】
无。
【Bizengri不良反应】
• 最常见的不良反应(≥10%)是腹泻、肌肉骨骼疼痛、疲劳、恶心、输液相关反应(IRR)、呼吸困难、皮疹、便秘、呕吐、腹痛和水肿。
• 最常见的3级或4级实验室异常(≥2%)为GGT升高、血红蛋白降低、钠降低、血小板减少、AST升高、ALT升高、碱性磷酸酶升高、镁降低、磷酸盐降低、aPTT升高和胆红素升高。
【Bizengri警告和注意事项】
• 输液相关反应(IRR)/超敏反应/过敏性反应:本品可引起严重且危及生命的IRR、超敏反应和过敏反应。IRR的体征和症状可能包括发冷、恶心、发烧和咳嗽。请在配备紧急复苏设备的环境中使用本品,并且工作人员接受过监测IRR和急救药物的培训。在输注期间以及完成第一次输注后至少1小时内,以及根据临床指征密切监测患者是否出现IRR的体征和症状。对于≤3级IRR的患者,中断输注,并根据需要给予对症治疗。在症状消退后以减慢的速度恢复输注。如果出现4级或危及生命的IRR或超敏反应/过敏反应,立即停止输注并永久停用本品。
• 间质性肺疾病(ILD)/肺炎:本品可导致严重且危及生命的ILD/肺炎。监测ILD/肺炎的新发或恶化肺部症状(例如,呼吸困难、咳嗽、发烧)。对于疑似ILD/肺炎的患者,立即停用本品,并根据临床指征给予皮质类固醇。如果出现≥2级ILD/肺炎,应永久停用本品。
• 左心室功能障碍:本品可导致左心室功能障碍。在开始使用本品前、以及在治疗期间根据临床指征定期评估左心室射血分数(LVEF)。通过中断或停止治疗进行管理。对于LVEF低于45%或低于50%,且与基线相比绝对下降10%或更多的情况,应永久停用本品。对于有症状的充血性心力衰竭 (CHF)患者,应永久停用本品。
• 胚胎-胎儿毒性:根据作用机制,孕妇使用本品会对胎儿造成伤害。应告知患者接受本品治疗对胎儿的潜在风险。在开始使用本品之前,核实具有育龄女性的怀孕状况。建议具有育龄女性在接受本品治疗期间以及最后一次给药后的2个月内使用有效的避孕措施。
【Bizengri特殊人群中的使用】
• 孕妇:根据作用机制,孕妇使用本品会导致胎儿受到伤害。尚无关于孕妇使用本品告知药物相关风险的可用数据。
• 哺乳:目前尚无关于本品是否存在于人乳中、对母乳喂养婴儿的影响或对产奶量的影响的数据。
• 育龄男性和女性:建议具有育龄女性患者在接受本品治疗期间以及最后一次给药后的2个月内使用有效的避孕措施。
• 儿童:本品在儿童患者中的安全性和有效性尚未确定。
• 老年:年龄≥65岁的患者和年轻患者之间,尚未观察到有临床意义的安全性或疗效差异。
【Bizengri一般描述及作用机制】
Zenocutuzumab-zbco是一种低岩藻糖人源化全长免疫球蛋白G1(IgG1)双特异性HER2和HER3定向抗体。其分子量约为146 kDa,使用重组DNA技术在哺乳动物细胞系(中国仓鼠卵巢[CHO])中生产。
Zenocutuzumab-zbco是一种双特异性抗体,它与细胞(包括肿瘤细胞)表面表达的HER2和HER3的胞外结构域结合,抑制HER2:HER3二聚化并防止NRG1与HER3结合。通过PI3K- mTOR途径降低细胞增殖和信号传导。此外,还介导抗体依赖性细胞毒性(ADCC)。Zenocutuzumab-zbco在NRG1融合阳性肺癌和胰腺癌的小鼠模型中显示出抗肿瘤活性。
【Bizengri患者资讯资料】
1. 忠告患者有以上任何不良反应的症状应立即联系医护人员。
2. 忠告患者应主动告知正在使用的其他任何药物,包括处方药、非处方药等。
3. 告知女性患者怀孕期间使用本品可能会对胎儿造成伤害。建议育龄女性患者在接受本品治疗期间以及最后一次给药后的2个月内使用有效的避孕措施。
【Bizengri用药管理】
给药前准备阶段
1. 给药前稀释并制备Bizengri用于静脉输注。
2. 对于初次输注,应尽可能接近给药时间准备Bizengri,以便在发生输注相关反应时延长输注时间。
• 检查溶液是否透明至微乳白色、无色至微黄色。只要溶液和容器允许,注射用药品在给药前应目视检查是否有颗粒物质和变色。如果出现变色或可见颗粒,请勿使用。
• 从250mL输液袋中取出并丢弃37.5mL 0.9%氯化钠注射液。仅使用由聚氯乙烯(PVC)、聚烯烃或聚烯烃/聚酰胺复合塑料制成的输液袋。
• 从2个单剂量小瓶中共取出37.5mL的Bizengri,并加入上述输注袋中。输注袋中的最终体积应为250mL。丢弃小瓶中未使用的部分。
• 轻轻翻转袋子,混合溶液。切勿摇晃。
• 如果不立即使用,请将稀释溶液冷藏在2°C至8°C (36°F至46°F) 环境中,配制后避光保存,除非在配制后2小时内开始输注。
给药阶段
1. 如果输液时间超过建议的储存时间,则必须丢弃输液袋,并准备一个新的输液袋重新制备以继续输液。稀释的Bizengri溶液必须在以下时间内使用:
• 在室温[15°C至25°C(59°F至77°F)]下储存的输注溶液制备结束后6小时。
• 冷藏[2°C至8°C(36°F至46°F)]储存的输注液配制结束后28小时。
2. 如果稀释的Bizengri溶液已经冷藏,在给药之前先恢复至室温(大约30分钟)。
3. 使用由PVC、聚乙烯(PE)、聚氨酯(PUR)或聚丁二烯(PB)制成的输液器,通过静脉输注给药稀释的Bizengri溶液。该输液器配有一个在线、无菌、无热原、低蛋白结合聚醚砜(PES)过滤器(孔径0.2微米)。
4. 请勿将本品与其他药物同时输注在同一静脉输注管道中。
5. 通过外周或中心静脉进行输注。
6. 在本品输注期间密切监测患者输注相关反应的体征和症状,并在完成第一次Bizengri输注后至少1小时以及根据临床指征监测患者(见警告和注意事项)。
7. 静脉输液时间应在4小时以上。
信息来源:
[1]https://www.bizengri.com/pdf/pi.pdf
[2]https://www.partnertx.com/merus-announces-fda-approval-of-bizengri-zenocutuzumab-zbco-for-nrg1-pancreatic-adenocarcinoma-and-nrg1-non-small-cell-lung-cancer-nsclc-based-on-safety-and-efficacy-data-from-the/
注:以上说明书为高等医药院校的学生志愿者翻译(如有错漏,请帮忙指正),仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。