2024年11月20日,Jazz Pharmaceuticals(爵士制药)宣布,美国食品药品监督管理局(FDA)批准ZIIHERA(zanidatamab-hrii,泽尼达妥单抗)用于静脉输注治疗经FDA批准的测试检测为既往接受过治疗、无法切除或转移性HER2阳性(IHC3+)胆道癌(BTC)的成年患者。
【生产企业】:Jazz Pharmaceuticals(爵士制药)
【规格】:300mg/瓶*2/盒;复溶浓度为50mg/mL;稀释至0.4mg/mL-6mg/mL输液溶液
【商标】:ZIIHERA
【通用名】:zanidatamab-hrii
【中文名】:泽尼达妥单抗
【性状】:本品为单剂量小瓶,内含无菌、无防腐剂的注射用白色冻干粉
【贮藏】:ZIIHERA原包装存放在2ºC至8ºC (36ºF至46ºF) 的冰箱中,直至重新配制。请勿冻存。
【ZIIHERA适应症和用途】
ZIIHERA适用于静脉输注用于治疗经FDA批准的测试检测出既往接受过治疗、无法切除或转移性HER2阳性(IHC3+)胆道癌(BTC)的成年患者。
【ZIIHERA用法用量】
• 每2周静脉输注一次,推荐剂量为20mg/kg。请参阅文末【ZIIHERA用药管理】。
• 每次注射ZIIHERA前30-60分钟,给患者预先服用对乙酰氨基酚、抗组胺药和皮质类固醇,以防止潜在的输液相关反应(IRR)。
• 错过剂量:如果计划剂量延迟或错过,请尽快开始该剂量;不要等到下一次计划剂量。之后应调整给药时间表以保持两次剂量之间的2周间隔。
• 剂量调整:针对不良反应,建议将剂量减少为15mg/kg。对于不能耐受15mg/kg剂量的患者,应永久停用。
【ZIIHERA禁忌症】
无。
【ZIIHERA不良反应】
最常见的不良反应(≥20%)是腹泻、输液相关反应、腹痛和疲劳。
【ZIIHERA警告和注意事项】
• 胚胎-胎儿毒性:根据ZIIHERA作用机制,在给孕妇使用时会对胎儿造成伤害。给药前应核实育龄女性的怀孕状况。告知孕妇和育龄女性在怀孕期间或受孕前4个月内接触本品可能会对胎儿造成伤害。建议育龄女性在给药期间以及最后一剂药的4个月内采取有效的避孕措施。
• 左心室功能障碍:ZIIHERA可导致左心室射血分数(LVEF)下降。在开始使用ZIIHERA之前以及治疗期间定期评估LVEF。根据严重程度暂停或永久停用。
• 输液相关反应 (IRR):ZIIHERA可引起输液相关反应,每次输注ZIIHERA前应预先用药以防止潜在的IRR。根据严重程度中断输注、降低输注速度、或永久停用。即:在输液期间以及在完成输液后,根据临床指示监测患者是否出现IRR的体征和症状。准备好可立即使用的治疗IRR的药物和急救设备。如果出现IRR,请减慢或停止输液,并进行适当的医疗管理。监测患者直至IRR体征和症状完全消退后再恢复用药。对于复发性严重或危及生命的IRR的患者,应永久停用ZIIHERA。
• 腹泻:ZIIHERA可引起严重腹泻。如果出现腹泻,请根据临床指征进行止泻治疗。同时,需要根据临床指征进行诊断测试,以排除腹泻的其他原因。根据严重程度暂停或永久停用。
【ZIIHERA特殊人群中的使用】
• 孕妇:根据作用机制,ZIIHERA给孕妇使用时可能会对胎儿造成伤害。目前尚无关于本品在妊娠期使用的人体或动物数据。
• 哺乳:目前尚无关于ZIIHERA是否存在于人乳中、对母乳喂养婴儿的影响或对产奶量的影响的数据。
• 育龄女性和男性:给孕妇服用时可能会对胎儿造成伤害,详见【ZIIHERA警告和注意事项】。
• 儿科用药:ZIIHERA对儿科患者的安全性和有效性尚未确定。
• 老年人用药:临床试验中,老年患者与年轻成年患者在安全性或有效性方面没有观察到总体差异。
【ZIIHERA一般描述及作用机制】
HER2是一种刺激癌细胞快速生长的蛋白质,在包括胆道癌、膀胱癌、宫颈癌、子宫内膜癌、卵巢癌和胰腺癌等实体瘤中存在。Zanidatamab-hrii是一种双特异性HER2靶向抗体,可与HER2上的两个细胞外位点结合。Zanidatamab-hrii与HER2结合会导致内化,从而导致肿瘤细胞表面受体减少。Zanidatamab-hrii 可诱导补体依赖性细胞毒性 (CDC)、抗体依赖性细胞毒性 (ADCC) 和抗体依赖性细胞吞噬作用 (ADCP)。这些机制导致体外和体内肿瘤生长抑制和细胞死亡。
【ZIIHERA患者资讯资料】
1. 告知女性患者ZIIHERA对胎儿的潜在风险。建议女性患者在已知或怀疑怀孕的情况下,联系医护人员。建议育龄女性在给药期间以及最后一剂药的4个月内采取有效的避孕措施。详见(警告和注意事项)。
2. 忠告患者ZIIHERA可能导致心脏功能障碍,若出现心脏功能障碍相关体征和症状,应立即联系医护人员。
3. 告知患者输液相关反应的风险,若出现相关输液相关反应的症状,应立即联系医护人员。
4. 告知患者ZIIHERA可能导致不同程度的腹泻。指导患者如何控制腹泻,并联系医护人员以应对支持性治疗无反应的持续性腹泻。
【ZIIHERA用药管理】
ZIIHERA未为注射用冻干粉,仅通过复溶并稀释后以静脉输注方式给药。
1. 复溶
• 根据患者的体重计算推荐剂量以确定所需的药瓶数量。
• 将药瓶从冰箱中取出,并让药瓶达到室温。
• 用5.7mL无菌注射用水复溶每个药瓶(300mg),将水流缓慢引向瓶壁内侧,使最终浓度为50mg/mL,体积为6mL。
• 轻轻旋转药瓶,直至内容物完全溶解。不要摇晃或剧烈旋转。静置复溶的药瓶,直到气泡消失。
• 只要溶液和容器允许,在给药前应目视检查配制的溶液是否有颗粒物和变色。配制的溶液应为无色至淡黄色、透明至微乳白色,且无可见颗粒。丢弃任何有可见颗粒或变色的药瓶。
• 本产品不含防腐剂,配制的溶液应立即使用;如果不立即使用,请将配制的药瓶存放在室温15°C至30°C (59°F至86°F) 或冰箱2°C至8ºC (36°F至46ºF)下最多4小时。
2. 稀释
• 从每瓶中取出所需的剂量,将所需剂量体积缓慢加入含有0.9%氯化钠注射液或5%葡萄糖注射液的输液袋中,配制成稀释液的终浓度在0.4mg/mL至6mg/mL之间的输液溶液。
• 轻轻倒置输液袋以混合稀释溶液。不要摇晃袋子。
• 输液溶液必须是透明、无色且无可见颗粒的溶液。如果观察到可见颗粒或溶液变色,请勿使用。
• 丢弃单剂量小瓶中剩余的任何未使用部分。
• 稀释后应立即使用输液溶液或将输液溶液存放在室温(18°C至24°C [64°F至75°F])下最多12小时,或在冰箱(2ºC至8ºC [36ºF至46ºF])下最多24小时。
n 时间限制包括从开始复溶到输注期间。
n 如果超过了上述规定时间,请停止使用当前的输液袋,并准备一个新的输液袋,其中包含要输注的ZIIHERA的剩余剂量。
• 以下材料已证明与静脉给药材料和输液溶液兼容:
n 静脉(IV)袋:聚氯乙烯(PVC)、聚烯烃(PO)、乙基乙烯基乙酸酯(EVA)、聚丙烯(PP)和乙烯-丙烯共聚物。
n 输液器:聚氯乙烯/邻苯二甲酸二(2-乙基己基)酯(PVC/DEHP)。聚氨酯(PUR)、聚乙烯内衬(PE-lined)丙烯腈-丁二烯-苯乙烯(ABS)。
n 在线过滤器:聚醚砜溶液过滤器(PES)、聚偏氟乙烯空气过滤器(PVDF)。
n 封闭系统转移设备:丙烯腈-丁二烯-苯乙烯(ABS)、丙烯酸聚合物、聚碳酸酯(PC)、聚异戊二烯(PI)、聚酯、聚丙烯(PP)聚四氟乙烯(PTFE)、硅树脂和不锈钢(SS)。
3. 给药管理
• 使用0.2或0.22微米过滤器(由上述兼容材料组成)进行ZIIHERA静脉输注。
• 不要静脉推注或推注给药。
• 请勿通过同一输液管同时输注其他药物。
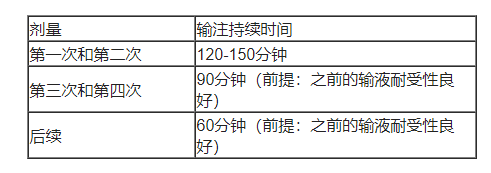
表1. ZIIHERA推荐输注时间
信息来源:
[1]https://pp.jazzpharma.com/pi/ziihera.en.USPI.pdf
[2]https://investor.jazzpharma.com/news-releases/news-release-details/jazz-pharmaceuticals-announces-us-fda-approval-ziiherar
注:以上说明书为高等医药院校的学生志愿者翻译(如有错漏,请帮忙指正),仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。