Kisunla是一种人源化免疫球蛋白γ1(IgG1)单克隆抗体,旨在针对和减少大脑中的淀粉样蛋白β斑块。该药物是首个有证据支持淀粉样蛋白斑块被清除后停止治疗的淀粉样蛋白斑块靶向疗法。
【生产企业】礼来(Lilly)
【规格】注射:350mg/20mL(17.5mg/mL),单剂量小瓶。
【商标】Kisunla
【通用名】donanemab-azbt
【中文名】多纳单抗
【贮藏】未开封的小瓶在2°C至8°C冷藏储存。将药瓶放在外箱中避光保存。不要冻结或摇晃。如果无法冷藏,可在室温(20°C至25°C)储存3天。
【Kisunla适应症】
Kisunla适用于治疗阿尔茨海默病。Kisunla治疗应开始于轻度认知障碍或轻度痴呆阶段的患者,即临床试验中开始治疗的人群。
【Kisunla推荐剂量和给药方法】
1、 患者选择
在开始治疗前确认β淀粉样蛋白病理学的存在。
2、 给药说明
Kisunla的推荐剂量为每四周700mg,共三次,然后每四周1400mg(见表1)。Kisunla每四周静脉输注约30分钟。Kisunla必须在给药前稀释(见表4)。根据淀粉样斑块在淀粉样PET成像中减少到最低水平,考虑停止给予Kisunla。在研究1中,根据PET成像中淀粉样蛋白水平降低至低于预定阈值,停止给药。如果错过输注,尽快以相同剂量每4周恢复给药。

3、 淀粉样蛋白相关成像异常的监测和剂量中断
Kisunla可导致淀粉样蛋白相关的成像异常-水肿(ARIA-E)和-含铁血黄素沉积(ARIA-H)。在开始使用Kisunla进行治疗之前,获取最近的基线脑磁共振成像(MRI)。在第2次、第3次、第4次和第7次输注前进行核磁共振成像。如果患者出现疑似ARIA的症状,应进行临床评估,包括MRI(如有必要)。
ARIA患者的剂量中断建议
Ÿ ARIA-E患者的给药中断建议见表2。
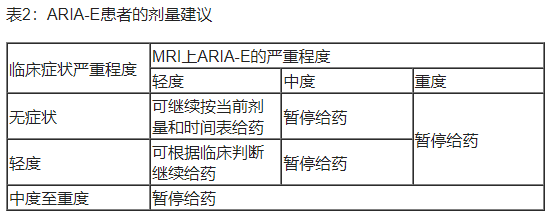 轻度:有不适感,但不影响正常的日常活动。
轻度:有不适感,但不影响正常的日常活动。
中度:不适足以减少或影响正常的日常活动。
严重:丧失能力,无法工作或进行正常的日常活动。
暂停给药:直到MRI显示射线照相分辨率和症状(如果存在)得到解决;考虑在初次识别后2至4个月进行MRI随访,以评估分辨率。应根据临床判断来指导重新给药。
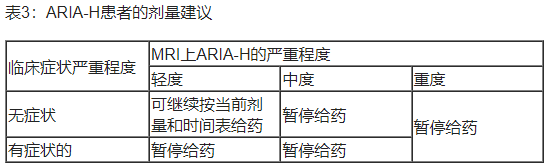
Ÿ ARIA-H患者的剂量中断建议见表3。
 Ÿ 对于在使用Kisunla治疗期间出现直径大于1cm的脑出血的患者,暂停给药,直到MRI显示影像学稳定且症状(如果存在)消失。应根据临床判断来指导重新给药。
Ÿ 对于在使用Kisunla治疗期间出现直径大于1cm的脑出血的患者,暂停给药,直到MRI显示影像学稳定且症状(如果存在)消失。应根据临床判断来指导重新给药。
4、 稀释说明
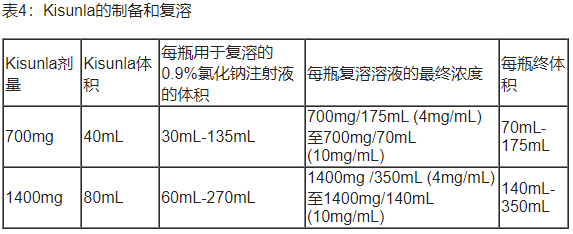
Ÿ 给药前,必须用0.9%氯化钠注射液稀释Kisunla(见表4)。
Ÿ 在制备用于静脉输注的稀释Kisunla溶液时,使用无菌技术。
Ÿ 在制备前,让Kisunla平衡至室温。只要溶液和容器允许,在给药前应对注射用药品进行目视检查,检查是否有颗粒物质和变色。Kisunla溶液为透明至乳白色,无色至微黄色至微棕色。如果有颗粒物质或变色,请勿使用。
Ÿ 提取所需体积的Kisunla,并与0.9%氯化钠注射液混合,达到建议的总体积,最终浓度为4 mg/mL至10 mg/mL(见表4)。仅使用0.9%氯化钠注射液进行稀释。
Ÿ 每个小瓶仅供一次性使用。丢弃小瓶中剩余的任何未使用部分。
Ÿ 轻轻倒置稀释的Kisunla溶液,使其完全混合。不要摇晃。
Ÿ 稀释后,建议立即使用。如果未立即服用稀释的Kisunla溶液,请在2°C至8°C下冷藏72小时,或在室温(20°C至25°C)下冷藏12小时。
Ÿ 不要冷冻稀释的Kisunla溶液。
Ÿ 储存时间包括输注的持续时间。
 5、 给药说明
5、 给药说明
Ÿ 给药前,目视检查稀释的Kisunla溶液是否有颗粒或变色。如果变色、不透明或有异物,请勿使用。
Ÿ 输注前,如果稀释溶液已冷藏保存,让稀释的Kisunla溶液升温至室温。
Ÿ 在大约30分钟内静脉注射全部稀释溶液。
Ÿ 首次观察到任何与过敏型反应一致的体征或症状时,立即停止输注。
Ÿ 在输注结束时仅用0.9%氯化钠注射液冲洗管路。
Ÿ 输注后观察患者至少30分钟,以评估输注反应和过敏反应。
【Kisunla的警告和注意事项】
一、 淀粉样蛋白相关的影像异常
针对聚集形式的β淀粉样蛋白(包括Kisunla)的单克隆抗体可导致淀粉样蛋白相关的成像异常(ARIA),表现为ARIA伴水肿(ARIA-E),在MRI上可观察到脑水肿或脑沟积液,以及ARIA伴含铁血黄素沉积(ARIA-H),包括微出血和表面铁质沉着。ARIA可在阿尔茨海默病患者中自发发生,特别是在MRI检查提示脑淀粉样血管病的患者中,如治疗前微出血或表面铁质沉着症。与针对聚集形式的β淀粉样蛋白的单克隆抗体相关的ARIAH通常与ARIA-E的发生相关。任何原因的ARIA-H和ARIA-E可以一起发生。ARIA通常在治疗早期出现,通常无症状,尽管很少会出现严重和危及生命的事件,包括癫痫发作和癫痫持续状态。当出现时,报告的与ARIA相关的症状可能包括但不限于头痛、意识模糊、视觉变化、头晕、恶心和步态困难。也可能出现局灶性神经功能缺损。与ARIA相关的症状通常会随着时间的推移而消失。除ARIA外,接受Kisunla治疗的患者还出现过直径大于1cm的脑出血。在决定开始使用Kisunla治疗时,考虑Kisunla治疗阿尔茨海默病的益处和ARIA相关的严重不良事件的潜在风险。在载脂蛋白E ε4 (ApoE ε4)纯合子中,ARIA(包括症状性和严重ARIA)的风险增加。
脑淀粉样血管病的影像学表现
可能提示CAA的神经影像学表现包括既往脑出血、脑微出血和皮质浅表铁质沉着症。CAA增加了脑出血的风险。ApoE ε4等位基因的存在也与脑淀粉样血管病相关。在研究1中,基线存在至少2次微出血或在MRI上存在至少1个表面铁质沉着区域,这可能提示CAA,被确定为ARIA的危险因素。研究1中的6名患者被排除在研究对象之外,因为他们之前在神经影像学上发现直径大于1 cm的脑出血、超过4次微出血、超过1个区域的表面铁质沉着症、严重的白质疾病和血管源性水肿。
伴随抗血栓或溶栓药物
暴露于抗血栓药物的大多数是阿司匹林。事件的数量和非阿司匹林抗血栓药物的有限暴露限制了对服用抗血栓药物的患者ARIA或脑出血风险的明确结论。在ARIA的局部神经症状和使用溶栓剂的情况下,一名服用Kisunla的患者发生了致命性脑出血。在考虑给正在接受Kisunla治疗的患者服用抗血栓药或溶栓剂(如组织型纤溶酶原激活剂)时,应格外小心。由于ARIA-E可导致类似缺血性中风的局灶性神经功能缺损,因此在对接受Kisunla治疗的患者进行溶栓治疗前,临床治疗医师应考虑这些症状是否由ARIA-E引起。在考虑将Kisunla用于存在脑出血风险增加因素的患者时,尤其是需要进行抗凝治疗的患者或MRI检查结果提示为脑淀粉样血管病的患者时,应谨慎。
ARIA-E患者的剂量建议
ARIA-H患者的剂量建议取决于ARIA-H的类型和放射检查的严重程度。使用临床判断来考虑是否对复发性ARIA-E患者继续给药。建议使用基线脑部MRI和定期MRI监测。在使用Kisunla治疗的前24周,建议加强对ARIA的临床警惕。如果患者出现ARIA的症状,应进行临床评估,包括MRI(如有必要)。如果在MRI上观察到ARIA,在继续治疗前应进行仔细的临床评估。通过无症状但放射检查为轻度至中度的ARIA-E持续给药的患者经验有限。经历ARIA-E反复发作的患者的给药数据有限。
二、 过敏反应
接受Kisunla治疗的患者出现了过敏反应和血管性水肿。在首次观察到与过敏反应一致的任何体征或症状时,立即停止输注,并开始适当的治疗。对donanemab-azbt或Kisunla的任何辅料有严重过敏史的患者禁用Kisunla。
三、 输液相关反应
输液相关反应的体征和症状包括寒战、红斑、恶心/呕吐、呼吸困难、出汗、血压升高、头痛、胸痛和低血压。如果出现输液相关反应,可能会降低输液速度,或中断输液,并根据临床指征开始适当的治疗。可考虑在后续给药前使用抗组胺药、对乙酰氨基酚或皮质类固醇进行预处理。
【Kisunla禁忌症】
已知对donanemab-azbt或任何辅料严重过敏的患者禁用Kisunla。
【Kisunla药物相互作用】
无相关信息。
【Kisunla不良反应】
标签中的其他地方描述了以下具有临床意义的不良反应:
Ÿ 淀粉样蛋白相关成像异常
Ÿ 过敏反应
Ÿ 输液相关反应
【Kisunla在特殊人群中使用】
1、 妊娠
尚无关于孕妇使用Kisunla的足够数据来评估药物相关的重大出生缺陷、流产或其他不利的母亲或胎儿结局的风险。尚未进行动物研究来评估Kisunla的潜在生殖或发育毒性。
2、 哺乳期
没有关于母乳中存在donanemab-azbt、对母乳喂养婴儿的影响或该药物对泌乳量的影响的数据。其他单克隆抗体的公布数据通常表明,单克隆抗体进入母乳的通过率较低,母乳喂养的婴儿全身暴露有限。这种有限暴露的影响是未知的。母乳喂养的发育和健康益处应与母亲对Kisunla的临床需求以及Kisunla或潜在母体状况对母乳喂养婴儿的任何潜在不利影响一起考虑。
3、 儿科用药
尚未确定Kisunla在儿科患者中的安全性和有效性。
4、 老年人使用
在研究1中,暴露于Kisunla的患者年龄范围为59至86岁,平均年龄为73岁;90%为65岁及以上,41%为75岁及以上。未观察到65岁患者与老年和年轻成年患者之间在Kisunla的安全性或有效性方面存在总体差异。
【Kisunla一般描述】
Donanemab-azbt是一种人源化免疫球蛋白γ1(IgG1)单克隆抗体,针对不可溶的Ntruncated焦谷氨酸淀粉样β蛋白,在中国仓鼠卵巢细胞系中表达。Donanemab-azbt的分子量约为145 kDa。
Kisunla (donanemab-azbt)注射液是一种无菌、不含防腐剂、澄清至乳白色、无色至微黄色至微棕色的溶液,稀释后可用于静脉输注。Kisunla以单剂量小瓶提供,浓度为350毫克/20毫升(17.5毫克/毫升)。
每毫升溶液含有17.5毫克Donanemab-azbt、无水柠檬酸(0.32毫克)、聚山梨醇酯80 (0.20毫克)、柠檬酸钠(2.15毫克)、蔗糖(80毫克)和注射用水,pH值为5.5至6.5。
【Kisunla作用机制】
Donanemab-azbt是一种人源化免疫球蛋白γ1(IgG1)单克隆抗体,针对不可溶的未捕获焦谷氨酸淀粉样β蛋白。大脑中淀粉样β蛋白斑块的积聚是阿尔茨海默病病的一个明确的病理生理学特征。Donanemab-azbt可以减少淀粉样β斑块。
【Kisunla患者资讯资料】
1. 淀粉样蛋白相关的影像异常:告知患者Kisunla可能会导致淀粉样蛋白相关的影像异常或“ARIA”。ARIA最常见的表现是大脑区域暂时肿胀,通常会随着时间的推移而消退。有些人还可能在大脑内部或表面有小出血点。告知患者,大脑区域肿胀的大多数人不会出现症状,但有些人可能会出现头痛、意识模糊、头晕、视力变化、恶心、失语、虚弱或癫痫发作等症状。如果出现这些症状,指导患者通知医生。告知患者,在服用Kisunla的患者中,直径大于1 cm的脑出血事件很少报告,服用Kisunla时使用抗血栓或溶栓药物可能会增加脑出血的风险。通知患者他们的医生将进行MRI扫描以监测ARIA。告知患者,虽然ARIA可发生在接受Kisunla治疗的任何患者中,但ApoE ε4纯合子患者的风险增加,并且应在开始治疗前进行ApoE ε4状态检测,以告知发生ARIA的风险。测试前,与患者讨论跨基因型的ARIA风险以及基因测试结果的含义。告知患者,如果不进行检测,无法确定他们是否是ApoE ε4纯合子,是否有更高的ARIA风险。告知患者ARIA的某些症状可能类似缺血性中风,他们的医生可能需要进行额外的测试,以确定如何治疗服用Kisunla的患者的这些症状。建议患者携带正在接受Kisunla治疗的信息。
2. 过敏反应:告知患者Kisunla可能会导致过敏反应和血管性水肿,如果出现过敏反应,请联系其医生。
3. 输注相关反应:告知患者Kisunla可能会导致输注相关反应,包括寒战、红斑、恶心、呕吐、呼吸困难、出汗、头痛、胸痛和高血压或低血压,如果出现输注相关反应,请联系医生。
信息来源:
https://pi.lilly.com/us/kisunla-uspi.pdf?s=pi#xd_co_f=NTZhOTQwYjUtNmM5YS00YWYwLTgxM2MtMzViZTVlZTA3Yzhi~
注:药品如有新包装,以新包装为准。以上说明书为高等医药院校的学生志愿者翻译(如有错漏,请帮忙指正),仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。