2021年8月26日,Ascendis Pharma公司宣布,美国FDA已批准Skytrofa(lonapegsomatropin-tcgd)上市,用于治疗一岁以上,体重至少11.5公斤,因内源性生长激素(GH)分泌不足而导致生长障碍的儿童患者。Skytrofa作为每周注射一次的针剂,是首个美国FDA批准的通过持续释放,在一周时间里递送生长激素的产品。
【生产企业】Ascendis Pharma公司
【规格】Skytrofa是一种冻干粉末,采用单剂量、双室、预装药筒,含有lonapegsomatropin-tcgd和稀释剂、注射用水,具体如下:注射用:3mg、3.6mg、4.3mg、5.2mg、6.3mg、7.6mg、9.1mg、11mg和13.3mg。
【商标】Skytrofa
【通用名】lonapegsomatropin-tcgd
【贮藏】
1、对于患者:将Skytrofa试剂盒放入外纸盒中,在2°C至8°C的温度下冷藏,避免光照,直至过期。不要冻结。或者,装有药筒的Skytrofa外箱可在室温[最高30°C]下储存长达6个月,并可在6个月内放回冰箱冷藏。在外箱上的空白处写上第一次从冰箱中取出的日期。请勿在Skytrofa过期后或首次从冰箱中取出后6个月内使用(以较早者为准)。
2、对于药房长期储存:将Skytrofa药筒冷藏在2°C至8°C的外箱中,避光保存,直至过期。不要冻结。
【Skytrofa适应症】
Skytrofa(lonapegsomatropin-tcgd)是一种人类生长激素,用于治疗体重至少为11.5kg且因内源性生长激素(gh)分泌不足而出现生长障碍的1岁及以上儿童患者。
【Skytrofa推荐剂量和给药方法】
1、 一般剂量信息
Ÿ 皮下注射,每周一次。
Ÿ Skytrofa治疗应由在诊断和管理因生长激素缺乏导致生长障碍的儿童患者方面经验丰富的医师监督(GHD)。
Ÿ 为了排除先前存在的视神经乳头水肿,在开始使用Skytrofa治疗前进行眼底镜检查,并在此后定期重新评估。
2、 建议剂量
Ÿ 对于初治患者和从每日生长激素治疗转为每日生长激素治疗的患者,Skytrofa的推荐剂量为0.24mg/kg体重,每周给药一次。
Ÿ 根据反应个性化和滴定Skytrofa的剂量。
Ÿ 从每日生长激素治疗改为每周一次Skytrofa时,在每日生长激素的最后一剂和每周一次Skytrofa的第一剂之间至少等待8小时。
Ÿ 评估依从性,并评估生长不良的其他原因,如甲状腺功能减退、营养不良、骨龄偏高和重组人生长激素抗体,如果患者无法增加身高速度,尤其是在治疗的第一年。
Ÿ 一旦发生骨骺融合,停止使用Skytrofa。
3、 错过的剂量
Ÿ 尽快使用漏服剂量,且不超过漏服剂量后2天。
Ÿ 为避免错过剂量,Skytrofa可在预定给药日前2天或后2天使用。在之前安排的给药日,恢复每周一次的下一次给药。
Ÿ 如果距预定日期已超过2天,则跳过该剂量,并在常规预定日期使用下一剂量。
Ÿ 两次给药之间应至少间隔5天。
4、 给药说明
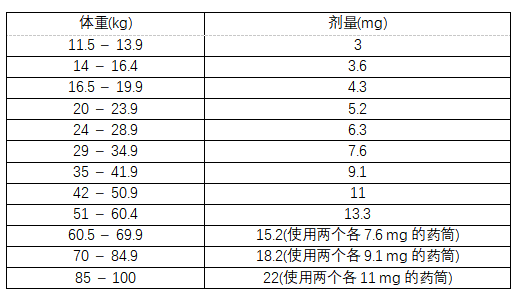
Skytrofa有9个药筒(剂量强度相当于生长激素)。根据处方剂量(mg/kg)和患者体重(kg)选择合适的药筒。
Ÿ 如果处方剂量为0.24mg/kg/周,且患者体重为11.5至100kg,请遵循表1中的推荐剂量。
Ÿ 如果处方剂量不是0.24mg/kg/周,计算总周剂量(单位为mg)并选择合适的药筒,如下所示:总周剂量(mg) =处方周剂量(mg/kg) x患者体重(kg)。
Ÿ 将每周总剂量(mg)四舍五入至最接近的药筒剂量,同时考虑治疗目标和临床反应。
表1:患者的推荐剂量处方剂量为0.24毫克/千克/周
5、 制备和给药
Ÿ Skytrofa药筒仅设计用于Skytrofa自动注射器。
Ÿ 如果冷藏,Skytrofa药筒在使用前必须在室温下保存15分钟。
Ÿ Skytrofa自动进样器可对冻干药品进行全自动复溶,然后通过设备控制手动混合步骤。当注射针插入皮肤时,该装置自动输送药物。
Ÿ 内置的电子设备和软件在整个准备和注射过程中为用户提供帮助,并确认已经注射了全部剂量。
Ÿ 混合溶液应该是透明的,无色至乳白色,偶尔可能含有气泡。如果溶液混浊或含有颗粒物质,请勿注射。
Ÿ 复溶后4小时内使用Skytrofa试剂盒。在高达30°C的室温下储存4小时后,丢弃复溶的Skytrofa试剂盒。
Ÿ 将Skytrofa皮下注射到腹部、臀部或大腿。在区域之间和区域内轮换注射部位,以降低脂肪萎缩的风险。
【Skytrofa的警告和注意事项】
一、 急性危重病患者死亡率增加
据报道,在接受药理剂量的生长激素治疗后,因心脏直视手术、腹部手术或多发性意外创伤引起的急性危重病患者或急性呼吸衰竭患者的死亡率增加。对于正在接受已批准适应症的替代剂量并同时患有这些疾病的患者,继续使用Skytrofa治疗的安全性尚未确定。
二、 严重过敏
生长激素产品(包括Skytrofa)上市后出现严重的全身过敏反应,包括过敏反应和血管性水肿。告知患者和/或护理人员可能出现此类反应,如果出现过敏反应,应立即就医。已知对生长激素或Skytrofa中的任何辅料过敏的患者禁用Skytrofa。
三、 肿瘤风险增加
活动性恶性肿瘤患者使用生长激素治疗会增加恶性肿瘤进展的风险。任何先前存在的恶性肿瘤都应该是无活性的,并且应该在开始使用Skytrofa治疗之前完成治疗。如果有复发恶性肿瘤的证据,停止Skytrofa。据报道,儿童癌症幸存者因其第一次肿瘤接受脑部/头部放射治疗,随后发展为生长激素缺乏症(GHD)并接受生长激素治疗的儿童患者的第二次肿瘤风险增加。颅内肿瘤,特别是脑膜瘤,是这些第二肿瘤中最常见的。对所有有继发于颅内肿瘤的GHD病史的患者进行生长激素治疗,监测肿瘤的进展或复发。
治疗期间出现新的恶性肿瘤:因为患有某些罕见的遗传原因导致的身材矮小的儿童患恶性肿瘤的风险增加,所以要充分考虑在这些患者中开始使用生长激素的风险和益处。如果开始用生长激素治疗,仔细监测这些病人肿瘤的发展。仔细监测接受生长激素治疗的患者是否有增长加快或原有痣的潜在恶性变化。建议患者/护理人员报告明显的行为变化、头痛发作、视力障碍和/或皮肤色素沉着变化或原有痣外观变化。
四、 葡萄糖耐受不良与糖尿病
用生长激素治疗可能会降低胰岛素敏感性,尤其是在较高剂量时。以前未被诊断的葡萄糖耐量异常和明显的二型糖尿病可能会被揭露。监测所有接受Skytrofa治疗的患者的血糖水平,尤其是那些有二型糖尿病病危险因素的患者,如肥胖或有二型糖尿病病家族史。开始使用Skytrofa时,密切监测已患有1型或二型糖尿病病或糖耐量异常的患者,并根据需要调整抗高血糖药物的剂量。
五、 颅内高压
少数接受生长激素治疗的患者出现了伴有视神经乳头水肿、视力改变、头痛、恶心和/或呕吐的颅内高压(IH)。症状通常出现在生长激素开始后的8周内。在所有报告的病例中,相关的体征和症状在停止治疗或减少生长激素剂量后迅速消失。为了排除先前存在的视神经乳头水肿,在开始使用Skytrofa治疗前进行眼底镜检查,并在此后定期重新评估。如果通过眼底镜观察到视神经乳头水肿,停止生长激素治疗。如果确认了生长激素诱导的IH,在IH相关的体征和症状消失后,重新开始用较低剂量的Skytrofa治疗。
六、 液体潴留
生长激素治疗期间可能出现液体潴留。液体潴留的临床表现(例如,水肿、关节痛、肌痛、神经压迫综合征,包括腕管综合征/感觉异常)通常是短暂的,并且是剂量依赖性的。
七、 肾上腺低能症
患有垂体激素缺乏症或有患垂体激素缺乏症风险的接受生长激素治疗的患者可能有血清皮质醇水平降低和/或暴露中枢性(继发性)肾上腺素减少症的风险。此外,在开始Skytrofa治疗后,接受糖皮质激素替代治疗的先前诊断为肾上腺素减少症的患者可能需要增加维持剂量或应激剂量。监测患者的血清皮质醇水平是否降低和/或已知肾上腺素减少的患者是否需要增加糖皮质激素剂量。
八、 甲状腺功能减退
未诊断或未治疗的甲状腺功能减退症可能会妨碍对Skytrofa的最佳反应。在GHD患者中,中枢性(继发性)甲状腺功能减退症可能首先在Skytrofa治疗期间变得明显或恶化。因此,定期对患者进行甲状腺功能测试,并在需要时启动或适当调整甲状腺激素替代疗法。
九、 股骨头骨骺滑脱和骨坏死
股骨头骨骺滑脱可能更经常发生在快速生长的患者中。评估有跛行发作或持续髋关节或膝关节疼痛主诉的儿童患者,因为在lonapegsomatropin治疗期间报告了股骨头骨骺滑脱。患者和护理人员应该意识到骨坏死被认为是人类生长激素产品的潜在风险。
十、 已有脊柱侧凸的进展
生长激素增加生长速度,快速生长的患者可出现已有脊柱侧凸的进展。生长激素并未显示会增加脊柱侧凸的发生率。监测有脊柱侧凸病史的患者的疾病进展。
十一、 胰腺炎
接受生长激素治疗的儿童患者中有胰腺炎的报道。儿童患者的风险可能比成人更大。考虑持续严重腹痛患者的胰腺炎。
十二、 脂肪萎缩
当Skytrofa在同一部位长期皮下给药时,可能导致脂肪萎缩。使用Skytrofa时,应轮换注射部位,以降低这种风险。
十三、 患有Prader-Willi综合征的儿童患者的猝死
有报告称,患有Prader-Willi综合征的儿童患者在开始使用生长激素治疗后死亡,这些患者具有以下一种或多种危险因素:严重肥胖、上呼吸道阻塞或睡眠呼吸暂停史或不明呼吸道感染。具有一种或多种上述因素的男性患者比女性患者风险更大。Skytrofa不适用于治疗因基因确诊的Prader-Willi综合征导致生长发育障碍的儿童患者。
十四、 实验室检查异常
血清磷酸盐、碱性磷酸酶和甲状旁腺激素水平在生长激素治疗后可能升高。如果发现患者的实验室检查异常,应进行适当的监测。
【Skytrofa禁忌症】
Skytrofa禁用于以下患者:
Ÿ 心脏直视手术、腹部手术或多次意外创伤后的急性危重病患者,或因使用药理剂量的生长激素有增加死亡率的风险而出现急性呼吸衰竭的患者。
Ÿ 对生长激素或Skytrofa中的任何辅料过敏。已经报告了严重的全身过敏反应,包括过敏反应和血管性水肿。
Ÿ 闭合骨骺。
Ÿ 由于恶性肿瘤恶化的风险而导致的活动性恶性肿瘤。
Ÿ 活动性增生性或严重非增生性糖尿病视网膜病变,因为使用生长激素治疗可能会使病情恶化。
Ÿ 严重肥胖、有上呼吸道阻塞或睡眠呼吸暂停病史或因猝死风险而有严重呼吸障碍的Prader-Willi综合征患者。
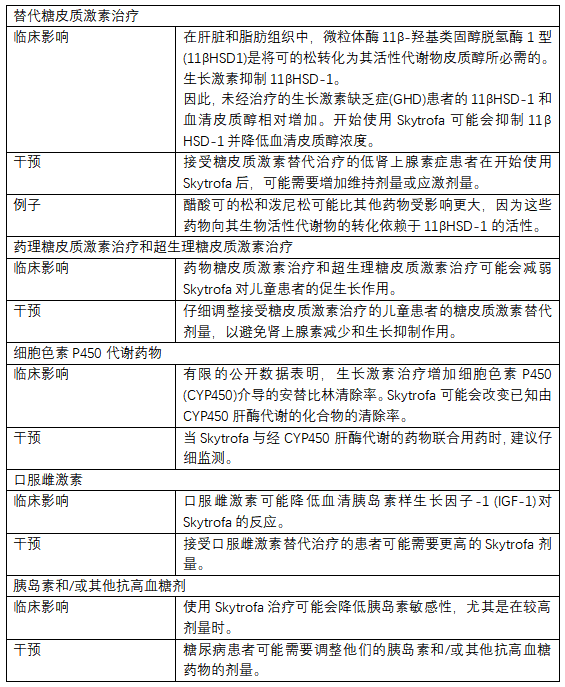
【Skytrofa药物相互作用】
表3列出了与Skytrofa同时给药时具有临床重要药物相互作用的药物,以及预防或管理这些药物的说明:
表3:临床上重要的药物与Skytrofa的相互作用
【Skytrofa不良反应】
标签中的其他地方描述了以下具有临床意义的不良反应:
Ÿ 急性危重病患者死亡率增加
Ÿ 严重过敏
Ÿ 肿瘤风险增加
Ÿ 葡萄糖耐受不良和糖尿病
Ÿ 颅内高压
Ÿ 液体潴留
Ÿ 肾上腺素减少
Ÿ 甲状腺功能减退症
Ÿ 儿童患者的股骨头骨骺滑脱和骨坏死
Ÿ 儿童患者原有脊柱侧凸的进展
Ÿ 胰腺炎
Ÿ 脂肪萎缩
Ÿ 患有Prader-Willi综合征的儿童患者的猝死
【Skytrofa在特殊人群中使用】
1、 妊娠
尚无关于妊娠患者使用lonapegsomatropin-tcgd评估重大出生缺陷、流产或不良母体或胎儿结果的药物相关风险的可用数据。几十年来,关于生长激素(lonapegsomatropin-tcgd的活性成分)的可用公开数据未发现与药物相关的重大出生缺陷、流产或不良母体或胎儿结果的风险。在动物生殖研究中,当怀孕大鼠皮下注射lonapegsomatropin-tcgd的剂量达到0.24毫克/千克/周临床剂量的13倍时,没有证据表明胚胎-胎儿或新生儿受到伤害。
2、 哺乳期
没有关于母乳中是否存在lonapegsomatropin-tcgd、对母乳喂养婴儿的影响或对泌乳量的影响的数据。包括lonapegsomatropin-tcgd在内的高分子量治疗性蛋白质预计很少进入母乳,并且在母乳喂养的婴儿中全身暴露有限。此外,已发表的数据表明,外源性生长激素不会增加正常人乳中生长激素的浓度。据报道,生长激素对母乳喂养的婴儿没有不良影响。应考虑母乳喂养的发育和健康益处,以及母亲对Skytrofa的临床需求,以及Skytrofa或潜在母体状况对母乳喂养婴儿的任何潜在不利影响。
3、 儿科用药
Skytrofa的安全性和有效性已在1岁及以上且体重至少为11.5 kg的儿科患者中得到证实。在一项对161名3至13岁未接受治疗的儿童患者的对照研究中,以及在1岁及以上儿童患者中的支持性数据中,确定了儿童用药。尚未确定Skytrofa对1岁以下儿童的安全性和有效性。Prader-Willi综合征儿童患者使用生长激素与猝死报告有关。Skytrofa不适用于治疗因基因确诊的Prader-Willi综合征导致生长障碍的儿童患者。
【Skytrofa药物滥用】
Ÿ 受管制物质:Skytrofa是生长激素的前体药物。生长激素不是受管制物质。
Ÿ 不当使用生长激素可能会导致严重的不良健康后果。生长激素依赖性与药物相关的戒断不良反应无关。
Ÿ 用药过量:急性用药过量最初可能导致低血糖,随后可能导致高血糖。生长激素过量可能导致液体潴留。长期过量可能导致巨人症的体征和症状,这与已知的过量生长激素的影响一致。
【Skytrofa一般描述】
Lonapegsomatropin-tcgd是一种使用大肠杆菌通过重组DNA技术生产的人生长激素(生长激素)的长效前药。Lonapegsomatropin-tcgd由母体药物生长激素组成,通过专有的TransCon接头与甲氧基聚乙二醇载体(4 x 10 kDa mPEG)结合,分子量为63 kDa(释放的生长激素为22 kDa)。体外试验证实释放的生长激素的最低效价为NLT 2.5 IU/mg。
注射用Skytrofa(lonapegsomatropin-tcgd)是一种无菌、不含防腐剂的白色至灰白色冻干粉末,采用单剂量、双腔预装药筒,其中一个腔室含有lonapegsomatropin-tcgd,另一个腔室含有稀释剂注射用水。Skytrofa预装药筒必须与Skytrofa自动注射器一起使用,以便在皮下注射前提供自动混合步骤。
复溶后,每个预装的试剂盒提供:
Ÿ 0.273mL,含有3mg lonapegsomatropin-tcgd、琥珀酸(0.32mg)、海藻糖二水合物(22.7mg)和氨丁三醇,用于将pH值调节至5。
Ÿ 0.327mL,含有3.6mg lonapegsomatropin-tcgd、琥珀酸(0.39mg)、海藻糖二水合物(27.1mg)和氨丁三醇,用于将pH值调节至5。
Ÿ 0.391mL,含4.3mg lonapegsomatropin-tcgd、琥珀酸(0.46mg)、海藻糖二水合物(32.5mg)和氨丁三醇,用于调节pH值至5。
Ÿ 0.473mL,含5.2mg lonapegsomatropin-tcgd、琥珀酸(0.56mg)、海藻糖二水合物(39.3mg)和氨丁三醇,用于调节pH值至5。
Ÿ 0.286mL,含6.3mg lonapegsomatropin-tcgd、琥珀酸(0.34mg)、海藻糖二水合物(21.2mg)和氨丁三醇,用于调节pH值至5。
Ÿ 0.345mL,含7.6mg lonapegsomatropin-tcgd、琥珀酸(0.41mg)、海藻糖二水合物(25.5mg)和氨丁三醇,用于调节pH值至5。
Ÿ 0.414mL,含9.1mg lonapegsomatropin-tcgd、琥珀酸(0.49mg)、海藻糖二水合物(30.6mg)和氨丁三醇,用于调节pH值至5。
Ÿ 0.5mL,含11mg lonapegsomatropin-tcgd、琥珀酸(0.59mg)、海藻糖二水合物(37mg)和氨丁三醇,用于调节pH值至5。
Ÿ 0.605mL,含13.3mg lonapegsomatropin-tcgd、琥珀酸(0.71mg)、海藻糖二水合物(44.8mg)和氨丁三醇,用于调节pH值至5。
【Skytrofa作用机制】
Skytrofa是一种聚乙二醇化的人类生长激素(生长激素),每周皮下注射一次。生长激素与靶细胞细胞膜上的生长激素(GH)受体结合,导致细胞内信号转导和一系列药效作用。生长激素具有直接的组织和代谢作用,以及由胰岛素样生长因子-1 (IGF-1)介导的间接作用,包括刺激软骨细胞分化和增殖、刺激肝脏葡萄糖输出、蛋白质合成和脂肪分解。由于生长激素对长骨生长板(骨骺)的作用,生长激素刺激生长激素缺乏症(GHD)儿童患者的骨骼生长。
【Skytrofa患者资讯资料】
1. 指导患者和/或护理人员正确处理针头,并警告不要重复使用针头。应使用适当的容器来处理用过的药筒和针头。
2. 建议患者和/或护理人员在一天中的任何时间每周使用一次Skytrofa。建议患者和/或护理人员可以在预定给药日的前2天或后2天服用药物。建议患者和/或护理人员在下一次给药时恢复每周一次给药。如果距预定给药日已超过2天,建议患者和/或护理人员跳过错过的剂量,并在常规预定日服用下一个剂量。如果随后将常规给药日改为一周中的不同日期,建议患者和/或护理人员确保最后一次给药与新确定的常规给药日之间至少相隔5天。
3. 过敏反应:告知患者和/或护理人员已经报告了严重和/或严重的全身过敏反应(过敏反应和血管性水肿),如果出现过敏反应,应立即就医。
4. 肿瘤:告知儿童癌症幸存者和/或护理人员,接受脑部和/或头部放射治疗的个体发生继发性肿瘤的风险增加,作为预防措施,需要监测复发情况。建议患者和/或护理人员报告明显的行为变化、头痛发作、视力障碍和/或皮肤色素沉着变化或原有痣外观变化。
5. 葡萄糖耐受不良/糖尿病:告知患者和/或护理人员,可能会出现新的葡萄糖耐受不良/二型糖尿病病或原有糖尿病的恶化,并且可能需要在使用Skytrofa治疗期间监测血糖。
6. 颅内高压:建议患者和/或护理人员向他们的医生报告任何视觉变化、头痛和恶心和/或呕吐。
7. 液体潴留:提醒患者和/或护理人员,在Skytrofa替代治疗期间可能会发生液体潴留。告知患者和/或护理人员液体潴留的临床表现(例如,水肿、关节痛、肌痛、神经压迫综合征,包括腕管综合征/感觉异常),并在使用Skytrofa治疗期间出现任何这些体征或症状时向其医生报告。
8. 肾上腺素减少症:告知患者和/或护理人员,患有垂体激素缺乏症或有患垂体激素缺乏症风险的患者可能会出现肾上腺素减少症,如果他们出现色素沉着过度、极度疲劳、头晕、虚弱或体重减轻,应向其医生报告。
9. 甲状腺功能减退症:建议患者和/或护理人员,未诊断/未治疗的甲状腺功能减退症可能会妨碍对Skytrofa的最佳反应。告知患者/护理人员,患者可能需要定期进行甲状腺功能检查。
10. 胰腺炎:告知患者和/或护理人员可能会出现胰腺炎,并向其医生报告任何新出现的腹痛。
信息来源:
https://ascendispharma.us/products/pi/skytrofa/skytrofa_pi.pdf
注:药品如有新包装,以新包装为准。以上说明书为香港济民药业翻译(如有错漏,请帮忙指正),仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。





