Yimmugo是一种新开发的用于静脉给药(IVIg)的多价免疫球蛋白G制剂,用于治疗2岁及以上患有原发性体液免疫缺陷(PI)的患者。这种无糖即用型溶液已在美国获得批准,可用于初级抗体缺乏综合征的替代治疗。
Yimmugo由健康志愿者捐献的混合血浆制成,提供针对各种感染因子的广谱浓缩多克隆免疫球蛋白G(IgG)抗体。使用冷乙醇分馏、辛酸沉淀以及阴离子和阳离子交换色谱的组合来制造该产品。
【生产企业】Grifols公司
【规格】Yimmugo是一种含有10% IgG (100mg/mL)的溶液:50mL中含5g,100mL中含10g,200mL中含20g。
【商标】Yimmugo
【通用名】静脉注射人免疫球蛋白,human-dira
【贮藏】将Yimmugo保存在原纸盒中,避免光照。在2℃到8℃之间冷藏。在有效期内,产品可在室温下(高于8℃且不超过25℃)储存不超过6个月。产品从冰箱中取出后,不得放回冰箱。请在产品纸箱上记录室温下开始储存的日期。不要冷冻。不要使用任何已冻结的溶液。
【Yimmugo适应症】
Yimmugo(静脉注射免疫球蛋白,human-dira)是一种10%的免疫球蛋白液体,用于治疗原发性体液免疫缺陷(PI),包括但不限于先天性无丙种球蛋白血症、常见变异免疫缺陷(CVID)、X-连锁无丙种球蛋白血症(XLA)、Wiskott-Aldrich综合征和2岁及以上患者的严重联合免疫缺陷(SCID)中的体液免疫缺陷。
【Yimmugo推荐剂量和给药方法】
仅供静脉注射使用。
一、 剂量
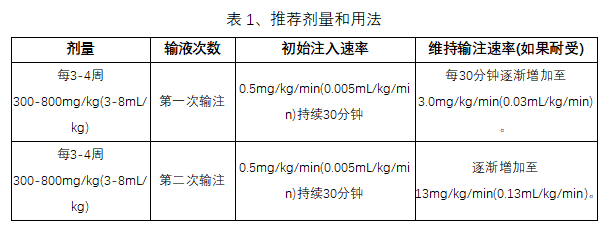
可以随时间调整剂量,以达到所需的谷值水平和临床反应。
二、 准备和处理
Ÿ Yimmugo是一种澄清至微乳白色、无色至淡黄色的溶液。只要溶液和容器允许,在给药前目视检查颗粒物质和变色。如果液体混浊或变色,或含有可见颗粒物质,请勿使用。
Ÿ 不要摇晃。
Ÿ 给药时,Yimmugo应处于室温或体温下。
Ÿ 不要与其他IGIV产品或其他静脉药物混合。
Ÿ 不要稀释。
Ÿ Yimmugo仅供一次性使用。它不含防腐剂。立即使用任何进入的小瓶。
Ÿ 根据当地要求,丢弃部分使用的小瓶和未使用的产品。
Ÿ 请勿在产品标签上的过期日期后使用Yimmugo。
三、 给药
通过静脉途径在室温或体温下服用Yimmugo。不要与任何静脉注射药物混合。关于输注速率,请参考表1。在整个输液过程中监控患者的生命体征。如果出现不良反应,减慢或停止输液。如果症状迅速消退,可以以患者感到舒适的较低速度继续输注。确保已有肾功能不全的患者不会出现容量衰竭。对于被判断为存在肾功能障碍或血栓形成事件风险的患者,以可行的最低输注速率给药Yimmugo,如果肾功能恶化,则考虑停止给药。开始输液前,给患者充分补充水分。
【Yimmugo的警告和注意事项】
1. 过敏
在使用Yimmugo后,出现了严重的过敏反应,包括过敏反应。如果出现过敏反应,立即停止输注Yimmugo,并采取适当的治疗措施。对于严重的急性过敏反应,应立即使用肾上腺素进行治疗。Yimmugo每毫升含有少于或等于300μg的IgA。已知有IgA抗体的患者发生严重过敏反应和过敏反应的风险更大。有IgA抗体和过敏反应史的IgA缺乏患者禁用Yimmugo。
2. 溶血
使用Yimmugo后出现溶血报告。IGIV产品(包括Yimmugo)可能含有可作为溶血素的血型抗体,可诱导免疫球蛋白在体内包裹红细胞(RBCs),导致直接抗球蛋白反应阳性和溶血。IGIV治疗后可出现迟发性溶血性贫血,原因是RBC隔离增强和急性溶血(与血管内溶血一致)。以下风险因素可能与IGIV给药后溶血的发生有关:高剂量(如≥2 g/kg,单次给药或分几天给药)和非O型血。其他个体患者因素,如潜在的炎症状态(可通过C-反应蛋白或红细胞沉降率升高反映出来)被假设为增加IGIV给药后的溶血风险,但其作用尚不确定。监测患者溶血的临床体征和症状。如果在输注Yimmugo后观察到溶血或血红蛋白或血细胞比容显著下降的临床体征和症状,请进行确认性实验室检测。如果接受IGIV后出现溶血并伴有贫血的患者需要输血,则应进行交叉配血,以避免加剧正在发生的溶血。
3. 溶血
使用免疫球蛋白产品 (包括Yimmugo)治疗后可能会出现血栓形成。风险因素可能包括:高龄、长时间制动、高凝状态、静脉或动脉血栓形成史、使用雌激素、留置中心血管导管、高粘滞血症和心血管风险因素。血栓形成可能在没有已知危险因素的情况下发生。考虑对有高粘滞血症风险的患者进行血液粘度基线评估,包括冷球蛋白血症、空腹乳糜微粒血症/显著高三酰甘油(甘油三酯)或单克隆丙种球蛋白病患者。对于有血栓形成风险的患者,以可行的最小剂量和输注速率给药Yimmugo。给药前确保患者充分水合。监测血栓形成的体征和症状,评估高粘滞血症风险患者的血液粘度。
4. 肾衰竭
使用人用IGIV产品可能会出现肾功能障碍、急性肾衰竭、渗透性肾病和死亡。在使用Yimmugo之前,确保患者没有容量耗尽。对于因已存在肾功能不全或易患急性肾功能衰竭(如糖尿病、低血容量、超重、合并使用肾毒性药物或年龄> 65岁)而有发生肾功能不全风险的患者,以可行的最低输注速率给药Yimmugo。对判断为急性肾衰竭风险增加的患者进行肾功能和尿量的定期监测。在首次输注Yimmugo之前和之后的适当时间间隔评估肾功能,包括测量血尿素氮(BUN)和血清肌酐。如果肾功能恶化,考虑停用Yimmugo。
5. 高蛋白血症、血清粘度增加和低钠血症
接受IGIV治疗(包括Yimmugo)的患者可能出现高蛋白血症、血清粘度增加和低钠血症。在临床上区分真性低钠血症和假性低钠血症是至关重要的,假性低钠血症与伴有计算血清渗透压降低或渗透压间隙升高的高蛋白血症相关或有因果关系,因为旨在降低假性低钠血症患者血清游离水的治疗可能导致容量衰竭、血清粘度进一步增加和可能的血栓栓塞事件诱因。
6. 无菌脑膜炎综合征
无菌性脑膜炎综合征(AMS)在接受IGIV治疗的患者中可能很少发生,包括Yimmugo。AMS通常在IGIV治疗后几小时至2天内开始。停止IGIV治疗可在几天内缓解AMS,且无后遗症。AMS的特征是以下体征和症状:严重头痛、项强直、嗜睡、发热、畏光、眼球运动疼痛、恶心和呕吐。脑脊液(CSF)研究经常显示每立方毫米高达数千个细胞的多细胞症,主要来自粒细胞系列,并且蛋白质水平升高至数百mg/dL,但是培养结果为阴性。对出现AMS体征和症状的患者进行彻底的神经病学检查,包括脑脊液检查,以排除脑膜炎的其他原因。高剂量(2g/kg)和/或快速输注IGIV可能会更频繁地出现AMS。
7. 输血相关急性肺损伤
接受IGIV治疗的患者可能出现非心源性肺水肿[输血相关急性肺损伤(TRALI)],包括Yimmugo。TRALI的特征是严重呼吸窘迫、肺水肿、低氧血症、左心室功能正常和发热。症状通常在治疗后1至6小时内出现。监测病人肺部的不良反应。如果怀疑TRALI,立即停止IGIV,并对产品和患者血清中的抗中性粒细胞抗体和抗人类白细胞抗原(HLA)抗体进行适当的检测。TRALI是一种潜在的威胁生命的情况,需要立即重症监护病房管理。TRALI可以通过氧疗和充分的通气支持来控制。
8. 传染性病原体
因为Yimmugo是由人的血液制成的,所以它可能具有传播传染性病原体的风险,例如病毒、变异型克雅二氏病(vCJD)和理论上的克雅二氏病(CJD)病原体。这也适用于未知或新出现的病毒和其他病原体。通过筛选血浆供体,并在Yimmugo的生产过程中加入病毒灭活以及病毒和朊病毒去除步骤,降低了传染性物质传播的风险。
9. 监测实验室测试
Ÿ 定期监测肾功能和尿量对于被判断为急性肾衰竭风险增加的患者尤为重要。在首次输注Yimmugo之前和之后的适当时间间隔评估肾功能,包括测量尿素氮和血清肌酐。
Ÿ 考虑对有高粘滞风险的患者进行血液粘度基线评估,包括冷球蛋白血症、空腹乳糜微粒血症/三酰甘油(甘油三酯)显著升高或单克隆丙种球蛋白病患者,因为血栓形成的风险可能增加。
Ÿ 如果在输注Yimmugo后出现溶血的体征和/或症状,请进行适当的实验室检测进行确认。
Ÿ 如果怀疑存在TRALI,应对产品和患者血清中的抗中性粒细胞抗体和抗HLA抗体进行适当的检测。
10. 对实验室测试的干扰
输注免疫球蛋白后,患者血液中各种被动转移抗体的短暂升高可能会产生阳性血清学检测结果,并有可能产生误导性解释。红细胞抗原(如A、B和D)的抗体被动传播可能导致直接或间接抗球蛋白(Coombs)试验阳性。
【Yimmugo禁忌症】
Ÿ 对人免疫球蛋白有过敏或严重全身反应的患者禁用Yimmugo。
Ÿ 有IgA抗体和过敏史的IgA缺乏症患者禁用Yimmugo。
【Yimmugo药物相互作用】
1. 静脉注射产品
临床研究尚未评估Yimmugo(静脉注射免疫球蛋白,human-dira)与其他静脉注射药物和溶液的混合物。将Yimmugo与患者可能正在服用的其他药物或药物分开服用。不要将Yimmugo与其他IGIVs产品混合使用。
2. 活病毒疫苗
免疫球蛋白给药可能会暂时削弱减毒活疫苗(如麻疹、腮腺炎、风疹和水痘)的效力,因为持续存在高水平的被动获得性抗体可能会干扰主动抗体反应。告知免疫医生最近使用Yimmugo进行的治疗,以便采取适当的措施。
3. 血清学测试
免疫球蛋白制剂中各种被动转移的抗体可能导致血清学检测结果的错误解释。
4. 袢利尿剂
避免同时使用袢利尿剂。IGIV同时使用袢利尿剂可能会导致血液粘度增加,从而增加血栓栓塞事件的风险。
【Yimmugo不良反应】
Yimmugo报告的常见的不良反应包括头痛、上呼吸道感染、疲劳、恶心、血压升高。Yimmugo可能会引起严重的副作用,并带有针对血栓形成、肾功能不全和急性肾功能衰竭的黑框警告。
【Yimmugo在特殊人群中使用】
1、 妊娠
没有人类数据表明存在或不存在药物相关风险。尚未对Yimmugo进行动物繁殖研究。尚不清楚孕妇使用Yimmugo后是否会对胎儿造成伤害或影响生殖能力。妊娠30周后,越来越多的免疫球蛋白从母体循环穿过胎盘。只有在明确需要的情况下,孕妇才应使用Yimmugo。
2、 哺乳期
没有人类数据表明存在或不存在药物相关风险。免疫球蛋白被分泌到母乳中。母乳喂养的发育和健康益处应与母亲对Yimmugo的临床需求以及Yimmugo对母乳喂养的婴儿的任何潜在不良影响或潜在的母体状况一起考虑。
3、 儿科用药
对18名PI患儿(12名2岁至12岁以下的儿童和6名12-16岁的青少年)进行了Yimmugo评估。儿童和成人的剂量需求没有区别。尚未对2岁以下儿童PI患者的安全性和有效性进行研究。
4、 老年用药
Yimmugo的临床研究没有纳入足够数量的65岁及以上患者,以确定他们的反应是否与年轻患者不同。其他报告的临床经验未发现老年患者和年轻患者之间的反应差异。一般而言,老年患者的剂量选择应谨慎,通常从剂量范围的低端开始,这反映了肝、肾或心功能下降以及伴随疾病或其他药物治疗的频率更高。不要超过推荐剂量,并以可行的最低输注速率给药。
【Yimmugo一般描述】
Yimmugo,静脉注射免疫球蛋白human-dira,是一种高度纯化、无菌、无热原、即用型10%浓缩多克隆人免疫球蛋白G (IgG)抗体液体制剂,用于静脉注射。该产品是无色至淡黄色的透明至微乳白色液体。活性成分是从人源血浆中纯化的人IgG,并使用冷乙醇分级分离、辛酸沉淀以及阴离子和阳离子交换色谱的组合进行处理。Yimmugo含有100±10mg/mL的蛋白质,其中不少于96%是IgG。IgG亚类的分布与正常血浆相似。将Yimmugo配制在注射用水中,其含有0.27至0.33mmol/mL甘氨酸、2至20mcg/mL聚山梨醇酯80,pH为4.4至5.2,重量克分子渗透压浓度范围为280至380 mOsmol/kg。Yimmugo含有不超过300μg/mL的IgA。
【Yimmugo作用机制】
Yimmugo提供针对各种病原体及其毒素的广谱调理和中和免疫球蛋白G(IgG)抗体,有助于避免反复出现严重的机会性感染。作用机制尚未完全阐明,但可能包括免疫调节作用。
【Yimmugo患者资讯资料】
告知患者对Yimmugo过敏反应的早期迹象(包括荨麻疹、全身性荨麻疹、胸闷、喘息、低血压和过敏反应),并建议他们在出现任何这些症状时通知医生。
指导使用Yimmugo的患者立即报告以下症状:
Ÿ 急性肾功能障碍和急性肾衰竭,可能包括尿量减少、体重突然增加、液体潴留/水肿和/或呼吸急促。此类症状可能提示肾脏受损。
Ÿ 血栓形成,可能包括手臂或腿/脚疼痛和/或肿胀,受影响区域发热,手臂或腿变色,不明原因的呼吸急促,深呼吸时加剧的急性胸痛或不适,不明原因的脉搏加快,身体一侧麻木或虚弱。
Ÿ 无菌性脑膜炎综合征(AMS),可能包括严重头痛、颈部僵硬、嗜睡、发烧、对光敏感、眼球运动疼痛、恶心和呕吐。
Ÿ 溶血,可能包括疲劳、心率加快、皮肤或眼睛发黄、深色尿液。
Ÿ 输血相关急性肺损伤(TRALI),包括呼吸困难、胸痛、嘴唇或四肢发青、发烧。
告知患者Yimmugo:
Ÿ 由人血浆制成,可能含有可导致疾病的感染因子(如病毒,理论上还有CJD因子)。虽然通过对血浆捐献者进行既往暴露筛查、检测捐献的血浆以及在生产过程中灭活或去除某些病毒,降低了Yimmugo传播感染的风险,但患者应报告任何与他们有关的症状。
Ÿ 会干扰他们对活病毒疫苗(如麻疹、腮腺炎、风疹和水痘)的免疫反应。指导患者在接种疫苗时将这种潜在的相互作用告知其医疗保健专业人员。
信息来源:
https://www.fda.gov/media/179364/download?attachment#xd_co_f=NTZhOTQwYjUtNmM5YS00YWYwLTgxM2MtMzViZTVlZTA3Yzhi~
注:以上资讯来源于网络,由香港济民药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。