2024年6月11日,再生元和赛诺菲制药公司联合宣布,美国FDA已批准IL-6R单抗Kevzara(sarilumab,萨瑞鲁单抗)用于治疗体重63kg或以上的活动性多关节幼年特发性关节炎(pJIA)患者,pJIA是一种一次影响多个关节的关节炎。
除了pJIA,Kevzara目前已在25个国家或地区获批用于治疗中度至重度活动性类风湿性关节炎成人患者。Kevzara还获FDA批准用于治疗风湿性多肌痛。
【生产企业】再生元和赛诺菲
【规格】注射:单剂量预填充笔中的150毫克/1.14毫升和200毫克/1.14毫升溶液。
【商标】Kevzara
【通用名】sarilumab
【中文名】萨瑞鲁单抗
【贮藏】在2°C到8°C的温度下冷藏在原纸盒中,以避免光照。不要冻结。不要摇晃。如果需要,患者/医生可以将Kevzara在室温高达25°C的条件下存放在外箱中长达14天。不要储存在25°C以上。从冰箱中取出后,在14天内使用Kevzara或丢弃。
【Kevzara适应症】
1、 类风湿性关节炎(RA)
Kevzara适用于对一种或多种缓解疾病的抗风湿药物(DMARDs)反应不良或不耐受的中度至重度活动性类风湿性关节炎成年患者的治疗。
2、 风湿性多肌痛(PMR)
Kevzara适用于治疗对皮质类固醇反应不足或无法耐受皮质类固醇减量的风湿性多肌痛成年患者。
3、 多关节幼年特发性关节炎(pJIA)
Kevzara适用于治疗体重63kg或以上的多关节幼年特发性关节炎(pJIA)。
【Kevzara推荐剂量和给药方法】
一、 给药前的一般注意事项
1)不建议与生物DMARDS同时使用:尚未研究Kevzara与生物DMARDs(如肿瘤坏死因子(TNF)拮抗剂、IL-IR拮抗剂、抗CD20单克隆抗体和选择性共刺激调节剂)的联合使用。避免将Kevzara与生物DMARDs一起使用,因为可能会增加免疫抑制的可能性和感染风险增加。
2)治疗前的推荐评估
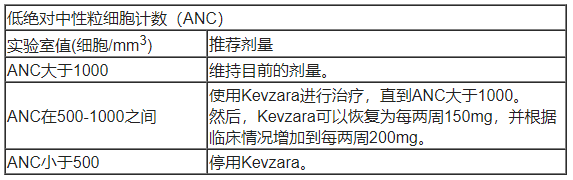
①全血计数(CBC):不建议中性粒细胞绝对计数(ANC)低于2000/mm3的患者开始使用Kevzara治疗或血小板计数低于150000/mm3。监控实验室参数。
②肝功能试验(LFT):不建议丙氨酸转氨酶(ALT)或天冬氨酸转氨酶(AST)高于上限1.5倍的患者开始使用Kevzara。监控实验室参数。
③血脂参数(总胆固醇、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇和/或甘油三酯):评估基线血脂参数。监控实验室参数。
④活动性和潜伏性结核病感染评估:在开始使用Kevzara之前,对患者进行活动性和潜伏性结核病(TB)检测。Kevzara不应用于活动性结核病患者。如果潜伏感染呈阳性,考虑在使用Kevzara前进行结核病治疗。
⑤评估感染:活动性感染患者避免使用Kevzara。
二、 类风湿性关节炎的推荐剂量
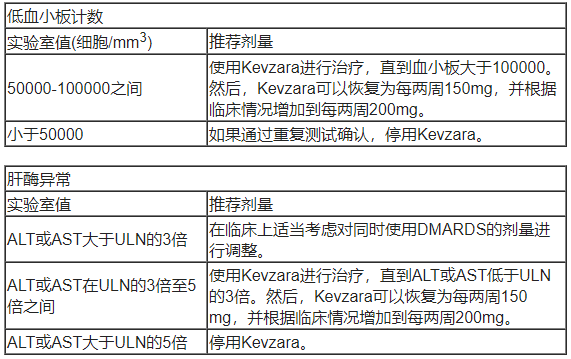
Kevzara的推荐剂量为200mg,每两周一次皮下注射。Kevzara可用于单一疗法或与甲氨蝶呤(MTX)或其他常规DMARDs联合使用。如果患者出现中性粒细胞减少、血小板减少或肝酶异常,请按照表2中的建议修改剂量。
三、 风湿性多肌痛的推荐剂量
Kevzara的推荐剂量为200 mg,每两周皮下注射一次,结合逐渐减少的全身皮质类固醇疗程。Kevzara可用于皮质类固醇停药后的单一疗法。如果患者出现中性粒细胞减少症(使用在给药间隔结束时获得的ANC结果)、血小板减少症或肝酶异常,则停用Kevzara。
四、 多关节幼年特发性关节炎的推荐剂量
体重大于或等于63kg的患者的Kevzara推荐剂量为每两周一次皮下注射200mg(最大剂量200mg)。该患者群体的剂量可通过使用200mg/1.14ml的预装注射器来实现。预充笔不适用于儿科患者。由于缺乏合适的剂型,Kevzara未被批准用于体重低于63kg的儿科患者。对于pJIA患者,Kevzara可单独使用或与常规DMARDs联合使用。
五、 制备和给药说明
注射用药品在给药前应目视检查是否有颗粒物质和变色。Kevzara溶液应为无色至淡黄色的透明溶液。如果溶液混浊、变色或含有颗粒,或者如果预充式注射器或预充式笔的任何部分出现损坏,请不要使用。每次注射时旋转注射部位。不要注射到柔嫩、受损或有瘀伤或疤痕的皮肤。
1)预填充笔和预填充注射器
①Kevzara适合在医生的指导下使用。患者可以自行注射Kevzara,或者患者的医生可以使用Kevzara。根据使用说明,在使用Kevzara之前,向患者和/或医生提供关于其制备和给药的适当培训(IFU)。
②皮下注射前,让预装注射器在室温下放置30分钟。不要以任何其他方式加热Kevzara。
③如果使用预充笔,在皮下注射前,让预充笔在室温下放置60分钟。不要以任何其他方式加热Kevzara。
④根据IFU提供的说明,指导患者在注射器或注射笔(1.14毫升)中注射全部量的Kevzara,这可提供200毫克或150毫克的Kevzara。
⑤儿科患者使用预填充笔进行自我注射的能力尚未经过测试。
六、 血细胞减少症、异常肝酶或感染的剂量调整
1)类风湿性关节炎患者的剂量调整
实验室异常:如表2所示,如果出现中性粒细胞减少症、血小板减少症或肝酶升高,应调整剂量。关于治疗开始标准,请参考类风湿性关节炎的剂量建议。
表2:类风湿性关节炎患者因中性粒细胞减少、血小板减少或肝酶升高而进行的剂量调整
2)感染:如果类风湿性关节炎患者出现严重感染或机会性感染,请继续使用Kevzara治疗,直到感染得到控制。
3)风湿性多肌痛患者的剂量调整
实验室异常:出现以下实验室异常的PMR患者应停用Kevzara:中性粒细胞减少症(给药间期结束时ANC低于1000/mm3);血小板减少症(血小板计数低于100,000/mm3);AST或ALT升高至ULN剂量3倍以上。尚未对出现这些情况的PMR患者进行剂量调整研究。关于治疗开始标准,请参考PMR的剂量建议。
感染:如果PMR患者出现严重感染或机会性感染,请使用Kevzara进行治疗,直到感染得到控制。
4)多关节幼年特发性关节炎患者的剂量调整
在pJIA人群中还没有研究减少Kevzara的剂量。如果ALT >5 ULN,血小板计数低于50,000细胞/mm3,中性粒细胞计数< 500细胞/mm3,同时伴有感染,停止Kevzara。如果ALT>3~5 ULN,血小板计数>50,000~100000细胞/mm3,中性粒细胞计数>500且<1000细胞/mm3时保持 Kevzara剂量直到临床状况得到改善。停用Kevzara的决定应基于对个体患者的医学评估。如果合适,应修改或停用甲氨蝶呤和/或其他药物的联合用药剂量。
【Kevzara的警告和注意事项】
一、 严重感染
根据报道,接受包括Kevzara在内的免疫抑制剂治疗的患者出现了由细菌、分枝杆菌、侵袭性真菌、病毒或其他机会性病原体引起的严重感染,有时甚至是致命感染。在机会性感染中,Kevzara报告了结核病、念珠菌病和肺孢子虫病。一些患者表现为播散性而非局限性疾病,并经常同时服用免疫抑制剂,如甲氨蝶呤或皮质类固醇。RA患者中最常观察到的Kevzara严重感染包括肺炎和蜂窝织炎。虽然Kevzara临床研究中未报告其他严重感染(如组织胞浆菌病、隐球菌病、曲霉病),但在接受其他免疫抑制剂治疗RA的患者中已有报告。避免在活动性感染患者中使用Kevzara,包括局部感染。
对于以下患者,在开始使用Kevzara前应考虑治疗的风险和益处:慢性或复发性感染;严重或机会性感染史;存在易受感染的潜在条件;接触过肺结核;或居住或旅行过结核病或真菌病流行地区。
在Kevzara治疗期间,密切监测患者感染体征和症状的发展情况,因为抑制急性期反应物可能会减轻急性炎症的体征和症状。如果患者出现严重感染或机会性感染,请暂停Kevzara治疗。对在Kevzara治疗期间出现新感染的免疫缺陷患者进行及时、完整的诊断检测;开始适当的抗菌治疗,并密切监测患者。
二、 肺结核
在开始使用Kevzara治疗之前,评估患者的结核病(TB)风险因素并测试潜伏感染。在开始使用Kevzara前,用标准抗分枝杆菌疗法治疗潜伏结核患者。对于既往有潜伏或活动期结核病史且不能确定充分疗程的患者,以及潜伏性结核试验阴性但有结核感染危险因素的患者,考虑在开始Kevzara治疗前进行抗结核治疗。当考虑抗结核治疗时,应咨询具有结核病专业知识的医生。密切监测患者的结核病体征和症状的发展,包括在开始治疗前潜伏性结核病感染测试呈阴性的患者。
三、 病毒再激活
免疫抑制生物疗法有病毒再激活的报道。在Kevzara的临床研究中观察到带状疱疹病例。由于排除了有乙肝病毒再激活风险的患者,因此Kevzara再激活乙肝病毒的风险未知。
四、 实验室异常
1)嗜中性白血球减少症
Kevzara治疗与中性粒细胞绝对计数(ANC)降低(包括中性粒细胞减少症)的发生率较高有关。开始Kevzara前评估中性粒细胞计数,治疗开始后4至8周监测中性粒细胞计数,此后每3个月监测一次。根据ANC变化的药效学,在考虑剂量调整时,使用给药间隔结束时获得的结果。
2)血小板减少症
在临床研究中,Kevzara治疗与血小板计数减少有关。开始Kevzara前评估血小板计数,治疗开始后4至8周监测血小板,此后每3个月监测一次。关于启动Kevzara疗法和根据血小板计数调整剂量的建议,请参见剂量和用法。
3)肝酶升高
Kevzara治疗与转氨酶升高的高发生率有关。这些升高是短暂的,在临床研究中没有导致任何临床上明显的肝损伤。当潜在肝毒性药物(如MTX)与Kevzara联合使用时,观察到这些升高的频率和幅度增加。在开始使用Kevzara前评估ALT/AST水平,并在治疗开始后4至8周监测ALT和AST水平,此后每3个月监测一次。当有临床指征时,考虑其他肝功能检查,如胆红素。关于开始Kevzara治疗和根据转氨酶升高调整剂量的建议,请参见剂量和用法。
4)脂质异常
使用Kevzara治疗会导致低密度脂蛋白胆固醇、高密度脂蛋白胆固醇和/或甘油三酯等血脂参数升高。开始使用Kevzara治疗后约4至8周评估血脂参数,然后每隔约6个月评估一次。根据高脂血症管理的临床指南来对患者进行治疗。
五、 胃肠穿孔
临床研究报告了胃肠道穿孔,主要是憩室炎的并发症。并发憩室炎或同时使用非甾体抗炎药或皮质类固醇可能会增加胃肠道穿孔的风险。及时评估出现新腹部症状的患者。
六、 免疫抑制
用免疫抑制剂治疗可能会增加恶性肿瘤的风险。Kevzara治疗对恶性肿瘤发展的影响尚不清楚,但在临床研究中报告了恶性肿瘤的发生。
七、 过敏反应
已有与Kevzara相关的过敏反应报告。在对照RA试验中,0.3%的患者报告了需要停止治疗的超敏反应。注射部位皮疹、皮疹和荨麻疹是最常见的过敏反应。建议患者如果出现任何过敏反应症状,立即就医。如果出现过敏反应或其他过敏反应,请立即停止服用Kevzara。请勿将Kevzara用于已知对sarilumab过敏的患者。
八、 活动性肝病和肝损伤
活动性肝病或肝损害患者不建议使用Kevzara治疗,因为Kevzara治疗与转氨酶升高有关。
九、 活疫苗
由于潜在的感染风险增加,在使用Kevzara治疗期间避免同时使用活疫苗;Kevzara治疗期间活疫苗的临床安全性尚未确定。没有关于接受活疫苗的人向接受Kevzara的患者二次传播感染的数据。在开始治疗之前,建议所有患者按照现行免疫指南及时进行所有免疫接种。活疫苗接种和开始Kevzara治疗之间的间隔应符合当前关于免疫抑制剂的疫苗接种指南。
【Kevzara禁忌症】
已知对sarilumab或任何非活性成分过敏的患者禁用Kevzara。
【Kevzara药物相互作用】
1、 与其他药物一起使用
群体药代动力学分析未检测到甲氨蝶呤(MTX)对sarilumab清除率的任何影响。Kevzara尚未与JAK抑制剂或生物DMARDs(如TNF拮抗剂)联合使用。
2、 与CYP450底物的相互作用
各种体外和有限的体内人体研究表明,细胞因子和细胞因子调节剂可以影响特定细胞色素P450(CYP)酶的表达和活性,因此有可能改变作为这些酶底物的同时给药药物的药代动力学。白细胞介素-6(IL-6)浓度升高可能下调CYP活性(如在类风湿性关节炎患者中),因此与无类风湿性关节炎的受试者相比,药物水平升高。通过IL-6Ra拮抗剂如Kevzara阻断IL-6信号传导可能逆转IL-6的抑制作用并恢复CYP活性,导致药物浓度改变。Kevzara对CYP酶的IL-6效应的调节可能与治疗指数较窄的CYP底物临床相关,其中剂量需要单独调整。在开始或停用Kevzara后,对接受CYP基质药物治疗的患者进行疗效监测(如华法林)或药物浓度监测(如茶碱),并根据需要调整药物的个体剂量。当Kevzara与CYP3A4底物药物(如口服避孕药、洛伐他汀、阿托伐他汀等)合用时,应小心谨慎。Kevzara对CYP450酶活性的影响可能在停止治疗后持续数周。
3、 活疫苗
在Kevzara治疗期间避免同时使用活疫苗。
【Kevzara不良反应】
标签中的其他地方描述了以下具有临床意义的不良反应:
Ÿ 严重感染
Ÿ 中性粒细胞减少症
Ÿ 血小板减少症
Ÿ 肝酶升高
Ÿ 血脂异常
Ÿ 胃肠道穿孔
Ÿ 免疫抑制
Ÿ 过敏反应。
【Kevzara在特殊人群中使用】
1、 妊娠
关于孕妇使用Kevzara的有限人类数据不足以说明重大出生缺陷和流产的药物相关风险。单克隆抗体,如Kevzara,在妊娠晚期通过胎盘主动转运,可能会影响子宫内暴露婴儿的免疫反应。从动物数据来看,与作用机制一致,在接受治疗的母亲的胎儿/婴儿中,应对抗原攻击的IgG水平可能降低。在一项动物生殖研究中,包括对接受静脉注射sarilumab的猴子进行的胚胎和胎儿以及出生前和出生后发育的联合研究,没有证据表明暴露量高达人体最大推荐剂量的约84倍(MRHD)。文献表明,抑制IL-6信号传导可能干扰宫颈成熟和扩张以及子宫肌层收缩活动,导致分娩的潜在延迟。
2、 哺乳期
尚无关于母乳中是否存在sarilumab、该药物对母乳喂养婴儿的影响或该药物对泌乳量的影响的信息。母乳中存在母体IgG。如果sarilumab被转移到母乳中,胃肠道局部暴露和婴儿全身暴露sarilumab的潜在有限影响尚不清楚。由于缺乏哺乳期的临床数据,无法明确确定Kevzara对哺乳期婴儿的风险;因此,母乳喂养的发育和健康益处应与母亲对Kevzara的临床需求以及Kevzara或潜在母体疾病对母乳喂养的孩子的潜在不良影响一起考虑。
3、 儿科用药
Kevzara被批准用于体重大于或等于63kg的儿童患者的活动性多关节幼年特发性关节炎(pJIA)。Kevzara在该患者群体中的使用得到了以下证据的支持:Kevzara在成人RA患者中的充分且对照良好的研究、成人RA患者的药代动力学数据以及对2岁及以上pJIA儿童患者的药代动力学、药效学、剂量发现和安全性研究。由于缺乏合适的剂型,Kevzara未被批准用于体重低于63 kg的儿科患者。尚未确定Kevzara对2岁以下pJIA患儿的安全性和有效性。
4、 老年人使用
在临床研究中暴露于Kevzara的RA患者总数中,450名患者(15%)年龄在65岁及以上,48名患者(1.6%)年龄在75岁及以上。在临床研究中,在老年和年轻患者之间没有观察到安全性和有效性的总体差异。Kevzara和安慰剂治疗的65岁及以上患者的严重感染频率高于65岁以下患者。在临床研究(研究3)中暴露于Kevzara的PMR患者总数中,16名患者(27.1%)年龄在65岁以下,33名患者(55.9%)年龄在65岁至75岁之间,10名患者(17.0%)年龄在75岁及以上。PMR研究中的中位年龄为69.0岁,所有患者都在接受基线皮质类固醇治疗。Kevzara组和安慰剂组的严重感染发生率没有差异。在研究3中,老年患者和年轻患者之间没有观察到安全性的总体差异。一般来说,老年人群的感染率较高,因此在治疗老年人时应谨慎。
5、 肝脏损伤
Kevzara的安全性和有效性尚未在肝损伤患者中进行研究,包括HBV或丙型肝炎血清学阳性的患者。
6、 肾脏损伤
轻度至中度肾功能损害患者无需调整剂量。Kevzara尚未在严重肾功能损害患者中进行研究。
【Kevzara一般描述】
Sarilumab是IgG1亚类的人重组单克隆抗体,可与IL-6受体结合,分子量约为150 kDa。Sarilumab是通过重组DNA技术在中国仓鼠卵巢细胞悬浮培养中生产的。
皮下注射用Kevzara(sarilumab)注射液是一种pH值约为6.0的无菌、透明、无色至淡黄色无防腐剂溶液。Kevzara以单剂量预填充注射器和预填充笔的形式提供。
每个注射器或笔输送1.14毫升溶液,其中含有150毫克或200毫克sarilumab、精氨酸(8.94毫克)、组氨酸(3.71毫克)、聚山梨醇酯20(2.28毫克)、蔗糖(57毫克)和注射用水。
【Kevzara作用机制】
Sarilumab与可溶性和膜结合的IL-6受体(s1L-6R和mIL-6R)结合,并已显示出通过这些受体抑制IL-6介导的信号传导。IL-6是一种多效促炎细胞因子,由多种细胞类型产生,包括T细胞和B细胞、淋巴细胞、单核细胞和成纤维细胞。IL-6已被证明参与多种生理过程,如T细胞活化、免疫球蛋白分泌的诱导、肝脏急性期蛋白合成的启动以及造血前体细胞增殖和分化的刺激。滑膜和内皮细胞也产生IL-6,导致受炎性过程如类风湿性关节炎影响的关节中局部产生IL-6。
【Kevzara患者资讯资料】
1. 感染:告知患者Kevzara可能会降低他们对感染的抵抗力。当出现提示感染的症状时,指导患者立即联系医生,以确保快速评估和适当治疗。
2. 胃肠穿孔:告知患者,尤其是那些同时服用非甾体抗炎药和/或类固醇的患者,出现过胃穿孔。告知患者在临床研究中报告了Kevzara治疗的患者出现胃肠道穿孔,主要是憩室炎的并发症。当出现严重持续腹痛症状时,指导患者立即联系医生,以确保快速评估和适当治疗。
3. 超敏反应和严重过敏反应:评估患者是否适合在家中使用皮下注射。告知患者,一些接受过Kevzara治疗的患者出现了严重的过敏反应。告知患者如果他们出现任何严重过敏反应的症状,立即就医。
4. 注射技术说明:在患者开始使用Kevzara之前,以及每次患者补充药物时,指导患者和护理人员阅读使用说明,因为可能有他们需要了解的新信息。为患者和护理人员提供正确的皮下注射技术指导,包括无菌技术,以及如何正确使用预充式注射器或预充式笔。
5. 使用前,预填充注射器或预填充笔应分别在室温下放置30分钟或60分钟。注射器或笔应在从冰箱中取出后的14天内使用。应使用防刺穿容器来处理用过的预充式注射器或预充式笔,并且应放在儿童接触不到的地方。指导患者或护理人员该技术以及正确的预充式注射器或预充式笔处置,并警告不要重复使用这些物品。
信息来源:
https://products.sanofi.us/kevzara/kevzara.pdf
注:以上资讯来源于网络,由香港济民药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。