Tovorafenib是一款口服脑渗透高选择性II型RAF激酶抑制剂,旨在针对MAPK信号通路中的关键酶。它能够抑制携带BRAF融合或BRAF V600突变的肿瘤的生长,并且具有大脑渗透性。据FDA称,这是该机构首次批准系统性疗法用于治疗携带BRAF重排(包括融合)变异的儿童低级别胶质瘤患者。该药物也是唯一一种以片剂或口服混悬液形式每周给药一次的pLGG全身疗法,无论是否进食。
【生产厂家】 Day One Biopharmaceuticals, Inc.
【储存】
• 将Ojemda片剂/口服混悬液储存在68°F至77°F(20°C至25°C),允许的温度波动范围为15°C至30°C(59°F至86°F)[请参阅USP控制室温]。
• 如果瓶盖下的安全密封破损或缺失,请勿使用Ojemda口服混悬液。混悬液必须在复溶后立即使用。给药后丢弃瓶子(包括任何未使用的部分)和注射器。
【Ojemda适应症】
Ojemda适用于治疗6个月及以上患有复发性或难治性儿童低级别神经胶质瘤(LGG)的患者,这些患者含有BRAF融合或重排或BRAF V600突变。
【Ojemda推荐剂量和给药方法】
一、 患者选择
在开始使用Ojemda治疗前,确认是否存在BRAF融合或重排或BRAF V600突变。
二、 使用Ojemda前的推荐测试
开始使用Ojemda前,评估肝功能测试,包括ALT、AST和胆红素。
三、 推荐剂量
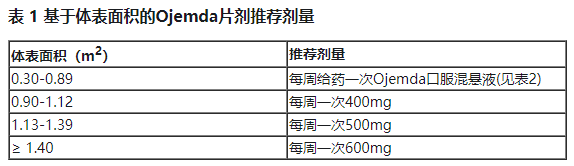
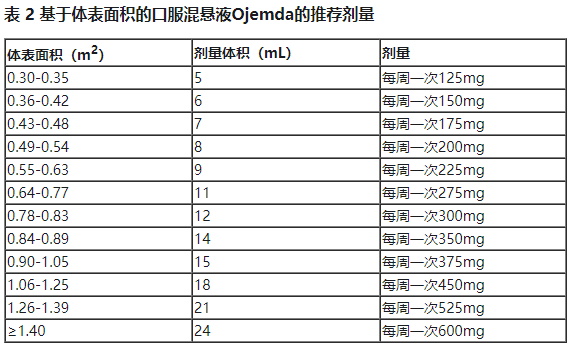
基于体表面积(BSA)的Ojemda推荐剂量为每周一次口服380mg/m2(最大推荐剂量为每周一次口服600 mg),可与食物同服或不同服,直至疾病进展或出现不可耐受的毒性。Ojemda可以作为速释片剂(见表1)或口服混悬液(见表2)给药。BSA小于0.3m2的患者的推荐剂量尚未确定。
继续每周给药一次,直到疾病进展或出现不可耐受的毒性。
四、 给药
• 每周定期服用一次Ojemda。
• Ojemda可与食物同服或不同服。
如果漏服一剂药:
• 3天或更短时间,请尽快服用漏服的一剂药,并在规定的日期服用下一剂药。
• 超过3天,跳过错过的剂量,并在其定期计划的日期服用下一剂。
如果服用一剂后立即出现呕吐,请重复该剂量。
Ojemda片剂:1)用水吞服药片。2)请勿咀嚼、切割或挤压。
Ojemda口服混悬液:在首次使用口服混悬液用Ojemda之前,确保护理人员(如适用,患者)在准备、测量和服用Ojemda之前阅读并理解“使用说明”。
制备和给药
• 用14mL室温水将每个随附瓶中的粉末复溶,形成Ojemda口服混悬液。复溶后,每毫升含25mg tovorafenib。复溶后产品起泡会减少可输送量。
• 每瓶含300mg的tovorafenib 12mL。对于大于300mg的剂量,重新配制两瓶以达到剂量。在两个瓶子之间尽可能平均分配剂量(例如,325mg剂量为6mL和7mL)。
• 制备后立即使用随附的口服剂量注射器或饲管(至少12 French)服用Ojemda口服混悬液。
• 如果口服混悬液用Ojemda未在制备后15分钟内给药,请告知患者将其丢弃。
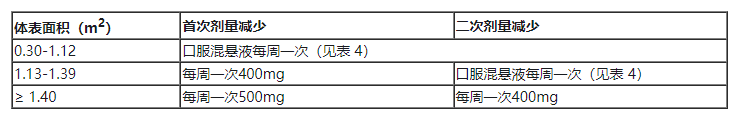
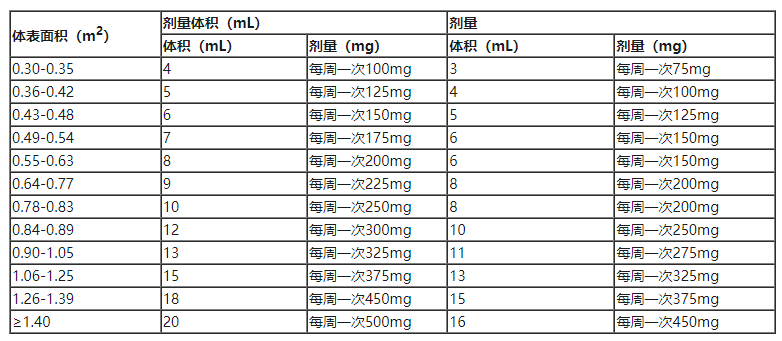
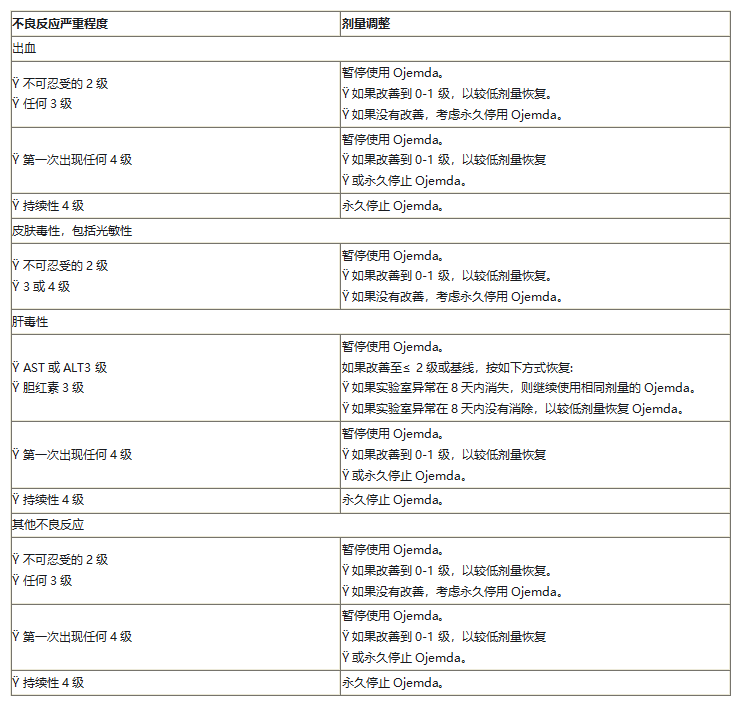
五、 针对不良反应的剂量调整
表3和表4分别列出了Ojemda片剂和Ojemda口服混悬液针对不良反应的建议减量。
表3 Ojemda片剂: 针对不良反应的建议减量
表4 Ojemda口服混悬液:不良反应的推荐减量
表5列出了Ojemda针对不良反应的推荐剂量调整。
表5 不良反应的推荐剂量调整
【Ojemda剂型和强度】
片剂:100mg,口服混悬液:25mg/ml
【Ojemda规格】
Ojemda片剂:100mg;橙色薄膜包衣椭圆形片剂,一面印有“100”,另一面印有“D101”,供应如下:
• 每盒4片吸塑卡(每张4片),NDC 82950-001-16。
• 每盒5张吸塑卡(每张4片),NDC 82950-001-20。
• 每盒4张吸塑卡(每张6片),NDC 82950-001-24。
Ojemda口服混悬液:25mg/ml;白色至灰白色粉末装在透明玻璃瓶中,与压入式瓶适配器和20毫升口服剂量注射器(NDC# 82950-012-01)一起包装。
每毫升重构的草莓味tovorafenib混悬液含有25mg tovorafenib。 每个瓶子在12mL中提供300mg tovorafenib。
【Ojemda的警告和注意事项】
1. 出血
Ojemda可能会导致出血,包括定义为关键区域或器官症状性出血的大出血。告知患者和护理人员使用Ojemda治疗期间的出血风险。监测出血的体征和症状,并根据临床指征进行评估。病情好转时停止用药并减少剂量继续用药,或根据严重程度永久停药。
2. 皮肤毒性,包括光敏性
Ojemda可引起皮疹,包括斑丘疹和光敏性。监测新的或恶化的皮肤反应。考虑皮肤科咨询并根据临床指征开始支持性护理。根据不良反应的严重程度暂停、减少剂量或永久停用Ojemda。建议患者在使用Ojemda治疗期间采取预防紫外线暴露的措施,例如使用防晒霜、太阳镜和/或防护服。根据不良反应的严重程度,暂停、减少剂量或永久停用Ojemda。
3. 肝毒性
Ojemda会导致肝中毒。在开始Ojemda之前、开始后一个月以及之后每三个月根据临床指征监测肝功能试验,包括ALT、AST和胆红素。病情改善后,暂停并恢复相同或减少剂量,或根据严重程度永久停用Ojemda。
4. 对生长的影响
Ojemda会导致生长速度降低。在使用Ojemda治疗期间,定期监测患者的生长情况。
5. 胚胎毒性
根据动物研究结果及其作用机制,孕妇服用Ojemda可能会对胎儿造成伤害。告知孕妇和女性生殖潜力对胎儿的潜在风险。建议有生育能力的女性在使用Ojemda治疗期间和最后一剂后的28天内使用有效的非激素避孕药,因为Ojemda可能导致某些激素避孕药无效。建议有生育能力女性伴侣的男性患者在接受Ojemda治疗期间以及最后一次给药后的2周内使用有效的非激素避孕药。
6. NF1相关肿瘤
根据NF1模型的非临床数据(没有BRAF变异),tovorafenib可能会促进NF1肿瘤患者的肿瘤生长。在开始使用Ojemda治疗前,确认BRAF改变的证据。
【Ojemda禁忌症】
无相关信息。
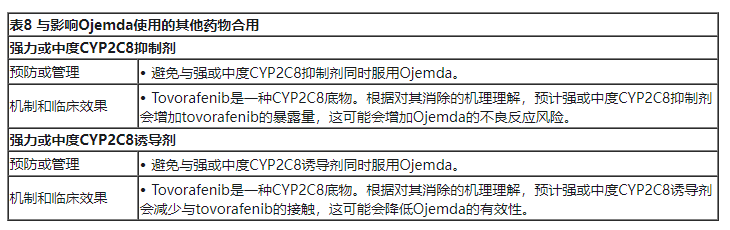
【Ojemda药物相互作用】
1. 其他药物对Ojemda的影响
表8描述了与另一种药物合用时影响Ojemda的药物相互作用。
2. Ojemda对其他药物的影响
表9描述了与Ojemda合用时会影响另一种药物的药物相互作用。
【Ojemda不良反应】
最常见的不良反应(≥30%)是皮疹、发色变化、疲劳、病毒感染、呕吐、头痛、出血、发热、皮肤干燥、便秘、恶心、痤疮样皮炎和上呼吸道感染。
最常见的3级或4级实验室异常(≥2%)为磷酸盐减少、血红蛋白减少、肌酐磷酸激酶增加、丙氨酸氨基转移酶增加、白蛋白减少、淋巴细胞减少、白细胞减少、天冬氨酸氨基转移酶增加、钾减少和钠减少。
【Ojemda在特殊人群中使用】
1、 妊娠
根据动物研究结果及其作用机制,孕妇服用Ojemda可能会对胎儿造成伤害。告知孕妇对胎儿的潜在风险。
2、 哺乳期
没有关于tovorafenib或其代谢物在母乳中的存在、其对母乳喂养儿童或乳汁分泌的影响的数据。由于Ojemda母乳喂养的儿童可能出现严重的不良反应,建议哺乳期妇女在Ojemda治疗期间以及最后一次给药后2周内不要进行母乳喂养。
3、 有生育能力的人群
孕妇服用Ojemda会对胎儿造成伤害。在开始使用Ojemda之前,妊娠测试可验证具有生育能力的女性的妊娠状态。建议有生育能力的女性在接受Ojemda治疗期间以及最后一次给药后的28天内使用有效的非激素避孕药。Ojemda可导致激素避孕药无效。建议有生育能力女性伴侣的男性患者在接受Ojemda治疗期间以及最后一次给药后2周内使用有效的非激素避孕方法。
4、 儿科用药
根据多中心、开放标签、单组临床试验的数据,Ojemda对6个月及以上患有BRAF融合或重排或BRAF V600突变的复发或难治性儿童LGG的儿童患者的安全性和有效性已得到证实。Ojemda在6个月以下患者中的安全性和有效性尚未确定。
5、 肝脏损伤
对于轻度(胆红素≤正常值上限(ULN)和丙氨酸氨基转移酶(AST)>ULN或胆红素>1倍至1.5倍ULN和任何AST)肝功能损害的患者,不建议调整剂量。尚未对中度(胆红素>1.5倍至3倍ULN和任何谷草转氨酶)至重度(胆红素>3倍ULN和任何谷草转氨酶)肝功能损害患者进行Ojemda研究。
6、 肾损伤
轻中度肾功能损害(eGFR ≥ 30 mL/min/1.73 m2按Schwartz方程或MDRD方程计算)患者不建议调整剂量。Ojemda尚未在严重肾功能损害(eGFR <30 mL/min/1.73 m2)患者中进行研究。
【Ojemda一般描述】
Ojemda含有一种激酶抑制剂tovorafenib。Tovorafenib的分子式为C17H12Cl2F3N7O2S,分子量为506.29。Tovorafenib的化学名称为6-氨基-5-氯-N-[(1R)-1-[5-[[5氯-4-(三氟甲基)-2-吡啶基]氨基]羰基]-2-噻唑基]乙基]-4-嘧啶甲酰胺。Tovorafenib具有以下化学结构:
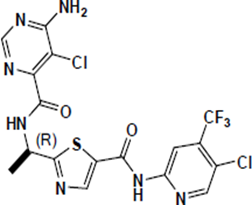
它是一种白色至灰白色粉末。Tovorafenib在37°C时在pH 1.2至8的水介质中的溶解度≤ 3μg/mL。Ojemda(tovorafenib)片剂以100mg口服片剂的形式提供。每片含有100mg tovorafenib和以下非活性成分:共聚维酮、胶体二氧化硅、交联羧甲基纤维素钠、硬脂酸镁、微晶纤维素和欧巴代橙。口服混悬液用Ojemda(tovorafenib)是一种白色至乳白色粉末,与水复溶后可产生白色混悬液。每mL重悬的tovorafenib混悬液含有25mg tovorafenib和以下非活性成分:人造草莓香精、胶体二氧化硅、共聚维酮、麦芽糊精、甘露醇、微晶纤维素、西甲硅油、十二烷基硫酸钠和三氯蔗糖。
【Ojemda作用机制】
Tovorafenib是突变BRAF V600E、野生型BRAF和野生型CRAF激酶的II型RAF激酶抑制剂。Tovorafenib在含有BRAF V600E和V600D突变的培养细胞和异种移植肿瘤模型以及含有BRAF融合的异种移植模型中显示出抗肿瘤活性。
【Ojemda患者资讯资料】
建议患者阅读FDA批准的患者标签。
1. 出血
告知患者Ojemda可能导致出血,并就出血迹象或症状联系医务人员。
2. 皮肤毒性
告知患者Ojemda可能导致皮肤毒性,并就恶化或不可耐受的皮疹联系医务人员。
3. 光敏性
建议患者注意Ojemda可引起光敏性。建议患者在使用Ojemda治疗期间限制直接紫外线暴露。建议患者在使用Ojemda治疗期间采取预防措施,例如使用防晒霜、太阳镜和/或防护服。
4. 肝毒性
告知患者Ojemda可能导致肝毒性,并就肝功能障碍的体征或症状联系医务人员。建议患者在使用Ojemda治疗期间进行一系列血清肝脏检测(ALT、AST、胆红素)。
5. 生长影响
告知患者和护理人员,使用Ojemda治疗可能会导致生长速度降低,并且在使用Ojemda治疗期间将监测生长情况。
6. 胚胎毒性
告知孕妇和有生育能力的女性对胎儿的潜在风险。建议女性在使用Ojemda治疗期间告知其医疗保健提供者已知或疑似怀孕的情况。建议具有生育能力的女性在治疗期间和停止Ojemda治疗后的28天内使用有效的非激素避孕方法。建议有生育能力女性伴侣的男性患者在接受Ojemda治疗期间以及最后一次给药后2周内使用有效的非激素避孕方法。
7. 哺乳期
建议女性在接受Ojemda治疗期间以及在最后一剂Ojemda后的2周内不要进行母乳喂养。
8. 不育
告知男性和女性Ojemda对生殖能力的潜在风险。
9. 剂量和给药
告知患者和护理人员如何服用Ojemda,以及如何处理遗漏或呕吐的剂量。在使用口服混悬液之前,确保患者或护理人员接受了关于正确给药、制备和给药的培训。
10. 储存
建议患者在准备使用前不要将Ojemda片剂从泡罩包装中取出。给药后丢弃瓶子(包括任何未使用的部分)和注射器。
信息来源:
https://www.accessdata.fda.gov/drugsatfda_docs/label/2024/218033s000lbl.pdf
注:药品如有新包装,以新包装为准。以上说明书为高等医药院校的学生志愿者翻译(如有错漏,请帮忙指正),仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。